Différences entre versions de « Réaction d'ionisation »
De Didaquest
Aller à la navigationAller à la recherche| (7 versions intermédiaires par le même utilisateur non affichées) | |||
| Ligne 16 : | Ligne 16 : | ||
<!-- Remplacer et adapter le contenu --> | <!-- Remplacer et adapter le contenu --> | ||
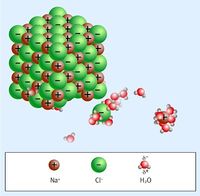
| − | * Une réaction de dissociation ou d'ionisation est une réaction au cours de laquelle un composé [[se dissocie]] (sépare) dans l'eau en se décomposant en ions : [[cation]] et [[anion]]. | + | * Une réaction de dissociation ionique ou d'ionisation est une réaction au cours de laquelle un composé [[se dissocie]] (sépare) dans l'eau en se décomposant en ions : [[cation]] et [[anion]]. |
{{Widget:Fin-cadre-Bleu}} | {{Widget:Fin-cadre-Bleu}} | ||
| Ligne 37 : | Ligne 37 : | ||
<!-- Remplacer et adapter le contenu --> | <!-- Remplacer et adapter le contenu --> | ||
| − | [[cation]] / [[anion]] | + | [[cation]] / [[anion]] / [[dissociation]] |
| Ligne 44 : | Ligne 44 : | ||
= {{Widget:Exemples-applications-utilisations-Fiche}} = | = {{Widget:Exemples-applications-utilisations-Fiche}} = | ||
| − | * Exemple: la dissolution du sel dans l'eau est une | + | * Exemple: la dissolution du sel dans l'eau est une réaction d'ionisation. |
* Application: production du courant électrique par déplacement des ions. | * Application: production du courant électrique par déplacement des ions. | ||
= {{Widget:Erreurs-confusions-Fiche}} = | = {{Widget:Erreurs-confusions-Fiche}} = | ||
| − | * Erreur: | + | * Erreur: Ecriture non équilibrée de l'équation de la réaction d'ionisation. |
| + | Détermination de la charge portée par les cations ou les anions. | ||
= {{Widget:Questions-possibles-Fiche}} = | = {{Widget:Questions-possibles-Fiche}} = | ||
| − | * Question:.. | + | * Question:Ecrire l’équation de la réaction d’ionisation d’un électrolyte. |
| − | + | Equilibrer l’équation de la réaction d’ionisation d’un électrolyte ( fort ou faible). | |
= {{Widget:Liens-enseignement-Fiche}} = | = {{Widget:Liens-enseignement-Fiche}} = | ||
| Ligne 66 : | Ligne 67 : | ||
= {{Widget:Difficultes-enseignement-Fiche}} = | = {{Widget:Difficultes-enseignement-Fiche}} = | ||
| − | + | Expliquer la dissociation d’un électrolyte en des cations et des anions. | |
= {{Widget:Liens-internet-Fiche}} = | = {{Widget:Liens-internet-Fiche}} = | ||
| Ligne 82 : | Ligne 83 : | ||
[[Category:Domaine ou Thématique ou Discipline]] | [[Category:Domaine ou Thématique ou Discipline]] | ||
[[Category: Fiches didactiques]] | [[Category: Fiches didactiques]] | ||
| + | [[Category:Superviseur May Amel]] | ||
Version actuelle datée du 26 janvier 2017 à 16:36
 Traduction
Traduction
réaction d'ionisation (Français) / Ionization reaction (Anglais) / رد فعل التأين (Arabe )
- Domaine, Discipline, Thématique :
Catégorie: Chimie / Catégorie: chimie des solutions
Définition écrite
|
Définition graphique
 Concepts ou notions associés
Concepts ou notions associés
|
|
 Exemples, applications, utilisations
Exemples, applications, utilisations
- Exemple: la dissolution du sel dans l'eau est une réaction d'ionisation.
- Application: production du courant électrique par déplacement des ions.
 Erreurs ou confusions éventuelles
Erreurs ou confusions éventuelles
- Erreur: Ecriture non équilibrée de l'équation de la réaction d'ionisation.
Détermination de la charge portée par les cations ou les anions.
 Questions possibles
Questions possibles
- Question:Ecrire l’équation de la réaction d’ionisation d’un électrolyte.
Equilibrer l’équation de la réaction d’ionisation d’un électrolyte ( fort ou faible).
 Liaisons enseignements et programmes
Liaisons enseignements et programmes
- Portail Formation Gratuite
- Multisites Educatifs
- Sur DidaQuest
- Sur le Portail Didactique.info
- Sur le Portail Questions / Réponses
- Concept Sur Wikipedia
- Concept Sur Wikiwand
- Concept Sur Wikiversity
 Aides, Astuces,...
Aides, Astuces,...
=
 Difficultés liées à son enseignement =
Expliquer la dissociation d’un électrolyte en des cations et des anions.
Difficultés liées à son enseignement =
Expliquer la dissociation d’un électrolyte en des cations et des anions.
 Liens Internet
Liens Internet
- URL :
- URL :