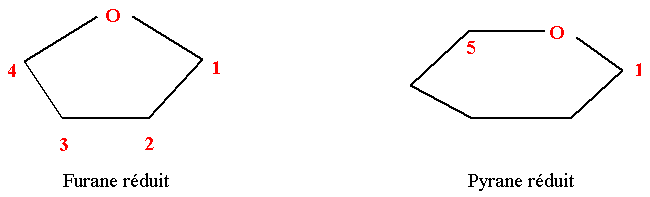Différences entre versions de « Glucides - Biochimie - Dossier »
| Ligne 82 : | Ligne 82 : | ||
* Ils sont rattachés au D-Glycéraldéhyde : la configuration spatiale de l’hydroxyle porté par le C subterminal de l’ose (ou Carbone n-1) est identique à celle du D-Glycéraldéhyde. | * Ils sont rattachés au D-Glycéraldéhyde : la configuration spatiale de l’hydroxyle porté par le C subterminal de l’ose (ou Carbone n-1) est identique à celle du D-Glycéraldéhyde. | ||
* La plus grande majorité des oses naturels sont de la série D. | * La plus grande majorité des oses naturels sont de la série D. | ||
| − | :2- Oses | + | :2- Oses de la série L |
* Ils dérivent par voie chimique du L-Glycéraldéhyde. | * Ils dérivent par voie chimique du L-Glycéraldéhyde. | ||
[[Fichier:Oses-d.gif|Filiation des oses selon Fischer (série D)]] | [[Fichier:Oses-d.gif|Filiation des oses selon Fischer (série D)]] | ||
| Ligne 98 : | Ligne 98 : | ||
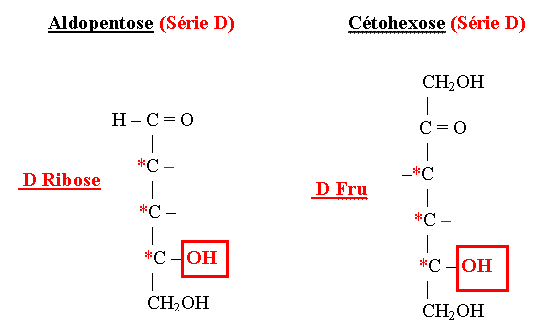
* Le Mannose est épimère en 2 du Glucose (c’est un épimère chimique = épimère vrai). | * Le Mannose est épimère en 2 du Glucose (c’est un épimère chimique = épimère vrai). | ||
[[Fichier:Aldopentose-cetohexose-d.gif]] | [[Fichier:Aldopentose-cetohexose-d.gif]] | ||
| + | |||
| + | |||
| + | === Objections à la structure linéaire des oses === | ||
| + | * En solution dans l’eau, les oses existent sous forme cyclique | ||
| + | * Nous citerons deux objections à la structure linéaire : | ||
| + | :1- '''Formation d’Acétal''' | ||
| + | ::::* Un aldose ou une cétone vrais fixe deux molécules d’alcool | ||
| + | [[Fichier:Image acetal.gif]] | ||
| + | |||
| + | :::* Un aldose ou un cétose ne fixent qu’une seule molécule d’alcool | ||
| + | [[Fichier:graphique92.trsp.gif]] | ||
| + | |||
| + | :2- '''Mutarotation (anomères)''' | ||
| + | La valeur du pouvoir rotatoire d’un ose (mesurée au polarimètre) n’est pas fixée immédiatement ; elle le devient au bout d’un certain temps. Ce phénomène est lié à l’existence de 2 formes isomériques, l’anomère α ou β à l’origine de la mutarotation. Ces 2 anomères différent par la position dans l’espace du OH hémiacétalique. | ||
| + | [[Fichier:graphique103.trsp.gif]] | ||
| + | |||
| + | :3- '''Ces objections''' permettent de montrer qu’en solution les oses existent non pas sous forme linéaire mais sous forme cyclique. | ||
| + | |||
| + | === Structure cyclique des oses : structure de Haworth === | ||
| + | Le cycle est formé par une liaison dans la molécule d’ose entre la fonction carbonylique (aldéhyde ou cétone) et un OH alcoolique := liaison hémiacétalique. | ||
| + | |||
| + | [[Fichier:oseshaworth.gif]] | ||
| + | |||
| + | La structure est '''convexe''' vers l’observateur. | ||
| + | |||
| + | Par cette convexité les C1 et C6 sont proches dans l’espace. | ||
| + | La rotation des valences autour du C5 permet de mettre sur un même plan les atomes participant à la cyclisation, soit : le C1, le C5 et l’Oxygène du C5. | ||
| + | |||
| + | Le cycle à 6 sommets qui en résulte est appelé pyranique car il est issu du pyrane. | ||
| + | |||
| + | === Intérêt de la structure cyclique === | ||
| + | La structure cyclique explique les objections à la structure linéaire des oses et les propriétés de ceux-ci : | ||
| + | |||
| + | :1- La fonction aldéhyde ou cétonique de l’ose, partiellement dissimulée (hémiacétal), est appelée pseudoaldéhydique ou pseudocétonique. | ||
| + | :2- Il existe un carbone asymétrique (C1 des aldoses ; C2 des cétoses) en raison de l’hémiacétalisation interne qui conduit à 2 anomères : α et β | ||
| + | :3- L’anomère α a un OH hémiacétalique du même côté que le OH porté par le C subterminal qui détermine la série. Il a le pouvoir rotatoire le plus élevé. | ||
| + | L’anomère β a les propriétés inverses. | ||
| + | |||
| + | === Structure cyclique des oses selon Haworth === | ||
| + | Deux structures cycliques sont possibles. | ||
| + | |||
| + | * '''La forme pyranique''' correspond à un hérérocycle à 6 sommets (5 C et 1 O). | ||
| + | * '''La forme furanique''' correspond à un hétérocycle à 5 sommets (4 C et 1 O). | ||
| + | |||
| + | [[Fichier:furpyr.gif]] | ||
| + | |||
| + | ==== D Glucopyranose ==== | ||
| + | * Le Glucose naturel (D (+) Glucose) est très répandu dans la nature. C’est le principal carburant de l’organisme et le carburant universel du fœtus. | ||
| + | * La polymérisation du Glucose conduit au Glycogène (foie, muscles). | ||
| + | * La glycémie est la concentration de Glucose à l’état libre dans le sang (0,80g/L soit 4,4 mM/L). | ||
| + | * Le Glucose est réducteur. La Glucose oxydase l’oxyde en acide aldonique : | ||
| + | [[Fichier:graphique134.trsp.gif]] | ||
| + | |||
| + | * Son pouvoir rotatoire est dextrogyre. | ||
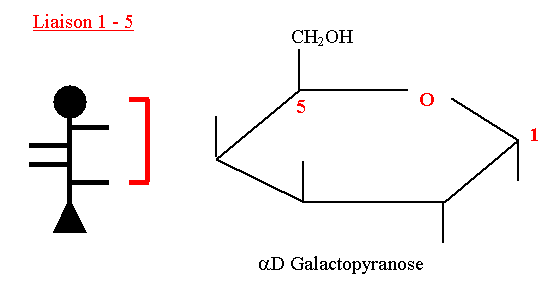
| + | ==== D-Galactopyranose ==== | ||
| + | Il intervient dans la composition de : | ||
| + | Lactose = D Gal + D Glc | ||
| + | Cérébrogalactosides du cerveau | ||
| + | Certains glycolipides et glycoprotéines | ||
| + | Son pouvoir rotatoire est dextrogyre. | ||
| + | |||
| + | [[Fichier:d-galacto.gif]] | ||
| + | |||
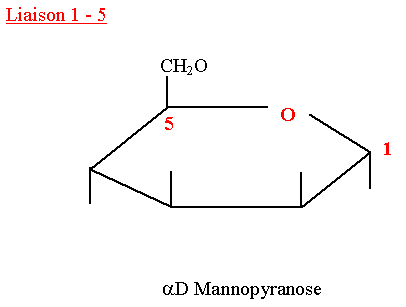
| + | ==== D-Mannopyranose ==== | ||
| + | Il est présent surtout dans les végétaux. | ||
| + | C’est un constituant des glycoprotéines chez l’homme. | ||
| + | Son pouvoir rotatoire est dextrogyre. | ||
| + | |||
| + | [[Fichier:d-manno.gif]] | ||
| + | |||
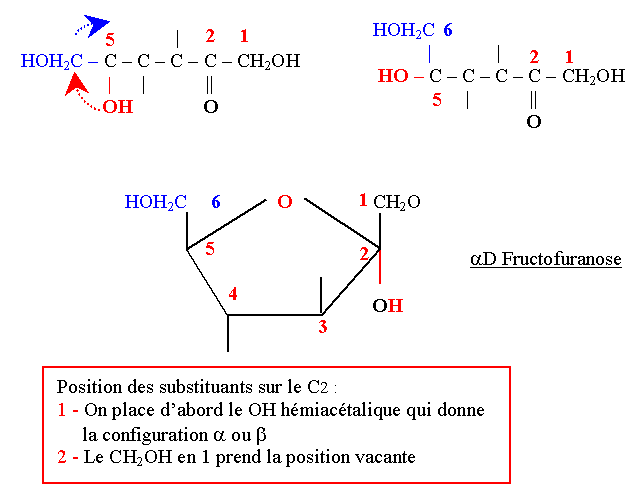
| + | ==== D-Fructofuranose ==== | ||
| + | On le trouve surtout dans les fruits d’où son nom. | ||
| + | Son pouvoir rotatoire est lévogyre d’où son nom de Lévulose. | ||
| + | Il est présent dans le liquide spermatique chez l’homme où il participe au mouvement des spermatozoïdes. | ||
| + | Il est présent sous forme furanique dans le saccharose. | ||
| + | La cyclisation se fait entre le C2 (cétone) et le C5. | ||
| + | |||
| + | [[Fichier:d-fructo.gif]] | ||
| + | |||
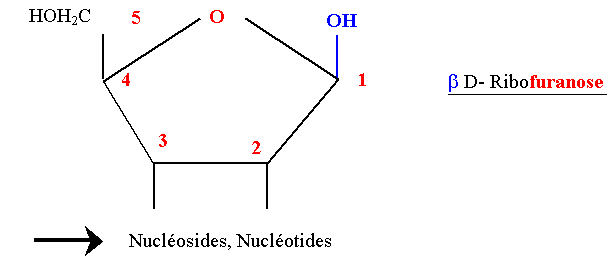
| + | ==== D Ribofuranose ==== | ||
| + | La forme furanique est la forme habituelle des pentoses combinés dans les acides nucléiques (ARN). | ||
| + | Le βD Ribofuranose est lié aux bases puriques et pyrimidiques par une liaison N-osidique (nucléosides, nucléotides). | ||
| + | Il intervient dans la structure des coenzymes : NAD, NADP, ATP. | ||
| + | La forme biologique est la forme furanique (1 - 4) | ||
| + | |||
| + | |||
| + | [[Fichier:d-ribo.gif]] | ||
| + | |||
| + | Dans le Désoxyribose le OH en 2 est remplacé par H (ADN). | ||
| + | |||
| + | === | ||
Version du 23 octobre 2020 à 21:17
Définition
- Les glucides sont des molécules organiques dont les carbones sont porteurs
- - de fonctions alcools (alcool secondaire, alcool primaire);
- - d’une fonction aldéhyde ou cétonique (fonction carbonylique);
- - parfois d’une fonction acide ou aminée.
Au total, il s’agit d’aldéhyde ou de cétone polyhydroxylées car un carbone est porteur soit d’un aldéhyde soit d’une cétone, tous les autres carbones étant porteurs de fonctions alcools.
Rôle
Rôle énergétique
- 40 à 50 % des calories apportées par l’alimentation humaine sont des glucides.
- Ils ont un rôle de réserve énergétique dans le foie et les muscles (glycogène).
Rôle structural
Les glucides interviennent comme :
- Eléments de soutien (cellulose), de protection et de reconnaissance dans la cellule.
- Eléments de réserve des végétaux et animaux (glycogène, amidon).
- Constituants de molécules fondamentales : acides nucléiques, coenzymes, vitamines, …
- Ils représentent un fort pourcentage de la biomasse car la plus grande partie de la matière organique sur la Terre est glucidique.
Rôle économique
- Cellulose : milliards de tonnes / an
- Amidon, saccharose : millions de tonnes / an.
Place du glucose
- Principal carburant des tissus
- Seul carburant du fœtus
- Rôle fondamental car tous les glucides alimentaires sont absorbés sous forme de glucose ou convertis en glucose dans le foie.
- Tous les glucides sont synthétisés à partir du glucose dans l’organisme.
Classification
On distingue les oses et les osides.
Critères de classification des oses
Ces critères font appel au nombre d’atomes de carbone de l’ose et à la nature du carboxyle.
- Le nombre d’atomes de carbone : 3C (triose) ; 6C (hexose)
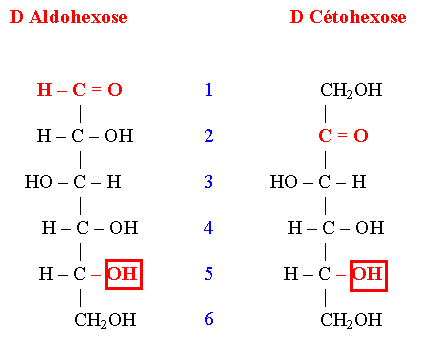
- La nature du carbonyle : Aldéhyde → Aldose ; Cétone → Cétose
- La combinaison de ces 2 critères caractérise l’ose :
- * Aldopentose, Aldohexose, …
- * Cétopentose, Cétohexose, …
Osides
Définition
Ce sont des molécules dont l’hydrolyse fournit 2 ou plusieurs molécules d’oses. Ces oses sont identiques ou différents. On en distingue 2 grands groupes : Holosides et Hétérosides.
Holosides
- Liaison de n molécules d’oses par des liaisons glycosidiques.
- Selon le nombre d’oses constitutifs : Di-, Tri, Tétra … holosides.
- Oligosides : jusqu’à quelques dizaines d’oses.
- Polyosides : quelques centaines d’oses (cellulose, amidon).
Hétérosides
- Ils donnent par hydrolyse : oses + aglycone (partie non sucrée).
- Liaison à des Protéines (glycoprotéines), à des Lipides (glycolipides), à des bases.
Oses
Structure linéaire des oses
Nomenclature
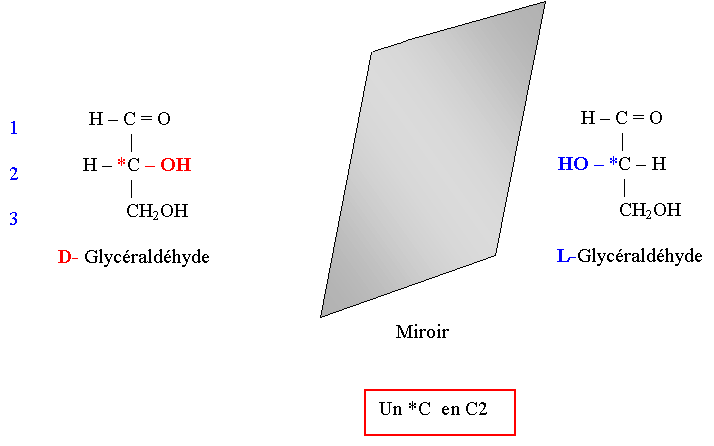
Structure du Glycéraldéhyde
Rappels sur le Carbone asymétrique
- 1- Il est porteur de 4 radicaux différents (exemple : C2 du glycéraldéhyde)
- 2- Isomères optiques ou énantiomères
- Isomère dextrogyre (+)
- Isomère lévogyre (-)
- Mélange équimoléculaire des 2 isomères : Racémique (DL) inactif sur la lumière polarisée.
- 3- Une molécule chirale est une molécule optiquement active :
- Elle renferme au moins 1 C asymétrique
- Elle n’a pas de plan de symétrie.
- 4- Configuration stéréochimique et pouvoir rotatoire d’un ose
En dehors du glycéraldéhyde, il n’y a aucune relation entre configuration stéréochimique de l’ose et son pouvoir rotatoire.
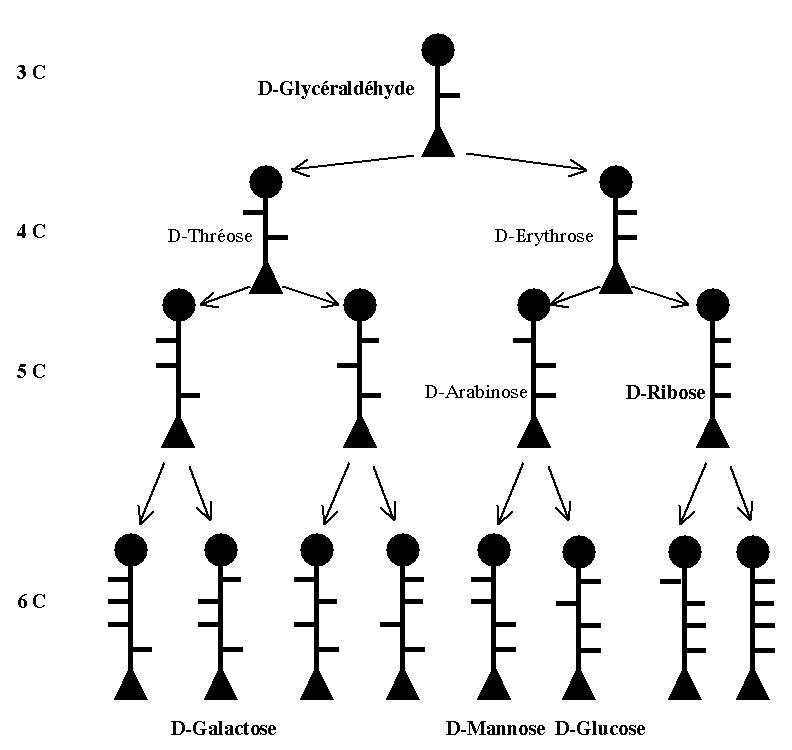
Filiation chimique des oses selon Fischer
- 1- Formation à partir du D-Glycéraldéhyde (par addition de C successifs)
Série D et L des oses
- 1- Oses de la série D
- Ils sont rattachés au D-Glycéraldéhyde : la configuration spatiale de l’hydroxyle porté par le C subterminal de l’ose (ou Carbone n-1) est identique à celle du D-Glycéraldéhyde.
- La plus grande majorité des oses naturels sont de la série D.
- 2- Oses de la série L
- Ils dérivent par voie chimique du L-Glycéraldéhyde.
Par addition successive d’un carbone, on obtient à chaque étape la formation de 2 isomères (1 triose → 2 tétroses → 4 pentoses → 8 hexoses).
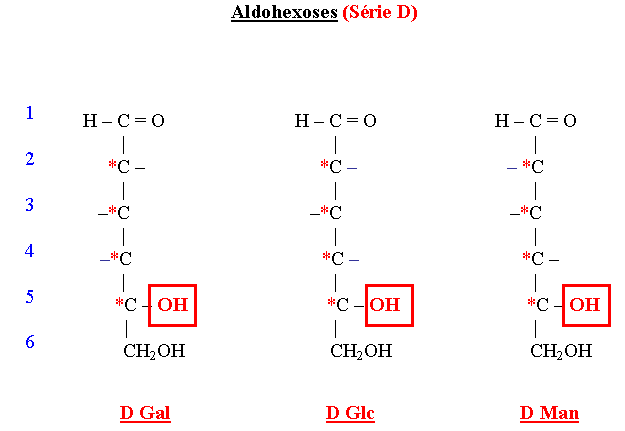
Principaux oses naturels selon Fischer
- Epimères
- L’épimérisation se fait par voie chimique ou enzymatique (épimérase).
- Le Galactose est épimère en 4 du Glucose. L’absence d’épimérase empêche la transformation du Galactose en Glucose et entraîne une des formes de la galactosémie congénitale du nouveau-né.
- Le Mannose est épimère en 2 du Glucose (c’est un épimère chimique = épimère vrai).
Objections à la structure linéaire des oses
- En solution dans l’eau, les oses existent sous forme cyclique
- Nous citerons deux objections à la structure linéaire :
- 1- Formation d’Acétal
- Un aldose ou une cétone vrais fixe deux molécules d’alcool
- Un aldose ou un cétose ne fixent qu’une seule molécule d’alcool
- 2- Mutarotation (anomères)
La valeur du pouvoir rotatoire d’un ose (mesurée au polarimètre) n’est pas fixée immédiatement ; elle le devient au bout d’un certain temps. Ce phénomène est lié à l’existence de 2 formes isomériques, l’anomère α ou β à l’origine de la mutarotation. Ces 2 anomères différent par la position dans l’espace du OH hémiacétalique.
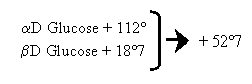
- 3- Ces objections permettent de montrer qu’en solution les oses existent non pas sous forme linéaire mais sous forme cyclique.
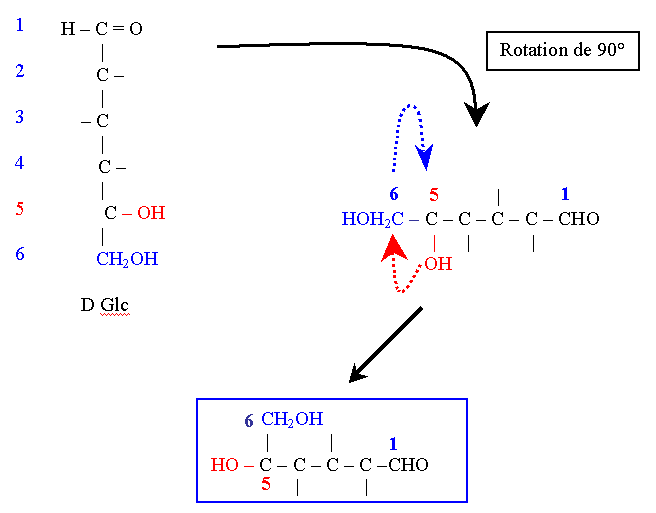
Structure cyclique des oses : structure de Haworth
Le cycle est formé par une liaison dans la molécule d’ose entre la fonction carbonylique (aldéhyde ou cétone) et un OH alcoolique := liaison hémiacétalique.
La structure est convexe vers l’observateur.
Par cette convexité les C1 et C6 sont proches dans l’espace. La rotation des valences autour du C5 permet de mettre sur un même plan les atomes participant à la cyclisation, soit : le C1, le C5 et l’Oxygène du C5.
Le cycle à 6 sommets qui en résulte est appelé pyranique car il est issu du pyrane.
Intérêt de la structure cyclique
La structure cyclique explique les objections à la structure linéaire des oses et les propriétés de ceux-ci :
- 1- La fonction aldéhyde ou cétonique de l’ose, partiellement dissimulée (hémiacétal), est appelée pseudoaldéhydique ou pseudocétonique.
- 2- Il existe un carbone asymétrique (C1 des aldoses ; C2 des cétoses) en raison de l’hémiacétalisation interne qui conduit à 2 anomères : α et β
- 3- L’anomère α a un OH hémiacétalique du même côté que le OH porté par le C subterminal qui détermine la série. Il a le pouvoir rotatoire le plus élevé.
L’anomère β a les propriétés inverses.
Structure cyclique des oses selon Haworth
Deux structures cycliques sont possibles.
- La forme pyranique correspond à un hérérocycle à 6 sommets (5 C et 1 O).
- La forme furanique correspond à un hétérocycle à 5 sommets (4 C et 1 O).
D Glucopyranose
- Le Glucose naturel (D (+) Glucose) est très répandu dans la nature. C’est le principal carburant de l’organisme et le carburant universel du fœtus.
- La polymérisation du Glucose conduit au Glycogène (foie, muscles).
- La glycémie est la concentration de Glucose à l’état libre dans le sang (0,80g/L soit 4,4 mM/L).
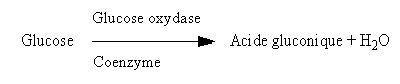
- Le Glucose est réducteur. La Glucose oxydase l’oxyde en acide aldonique :
- Son pouvoir rotatoire est dextrogyre.
D-Galactopyranose
Il intervient dans la composition de : Lactose = D Gal + D Glc Cérébrogalactosides du cerveau Certains glycolipides et glycoprotéines Son pouvoir rotatoire est dextrogyre.
D-Mannopyranose
Il est présent surtout dans les végétaux. C’est un constituant des glycoprotéines chez l’homme. Son pouvoir rotatoire est dextrogyre.
D-Fructofuranose
On le trouve surtout dans les fruits d’où son nom. Son pouvoir rotatoire est lévogyre d’où son nom de Lévulose. Il est présent dans le liquide spermatique chez l’homme où il participe au mouvement des spermatozoïdes. Il est présent sous forme furanique dans le saccharose. La cyclisation se fait entre le C2 (cétone) et le C5.
D Ribofuranose
La forme furanique est la forme habituelle des pentoses combinés dans les acides nucléiques (ARN). Le βD Ribofuranose est lié aux bases puriques et pyrimidiques par une liaison N-osidique (nucléosides, nucléotides). Il intervient dans la structure des coenzymes : NAD, NADP, ATP. La forme biologique est la forme furanique (1 - 4)
Dans le Désoxyribose le OH en 2 est remplacé par H (ADN).