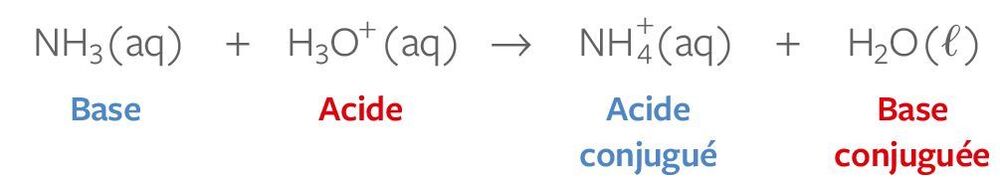Différences entre versions de « Acides et Bases »
De Didaquest
Aller à la navigationAller à la recherchem (Admin a déplacé la page Acide-Base vers Acides et Bases) |
|||
| (9 versions intermédiaires par un autre utilisateur non affichées) | |||
| Ligne 12 : | Ligne 12 : | ||
[[{{FULLPAGENAME}}]] (Français) | [[{{FULLPAGENAME}}]] (Français) | ||
| − | / [[ | + | / [[acid-base]] (Anglais) |
| − | / [[ | + | / [[المحاليل القلوية والشاردية]] (Arabe) |
}}<!-- ************** Fin Fiche Didactique Traduction ********************* --> | }}<!-- ************** Fin Fiche Didactique Traduction ********************* --> | ||
| Ligne 47 : | Ligne 47 : | ||
<!-- *************** Commercez les modifications *******************--> | <!-- *************** Commercez les modifications *******************--> | ||
| − | *.. | + | *Un acide est une substance chimique qui a une teneur élevée en ions hydronium (H3O+) en solution. Les acides peuvent réagir avec les bases pour former des sels et de l'eau. Les acides sont souvent décrits comme ayant un goût aigre et une réaction avec des métaux pour produire des gaz comme le dioxyde de carbone ou de l'hydrogène. |
| − | + | ||
| − | + | *Une base est une substance chimique différente d'un acide. Les bases ont une teneur élevée en ions hydroxyle (OH-) en solution et peuvent réagir avec les acides pour former des sels et de l'eau. Les bases sont souvent décrites comme ayant un goût alcalin et une réaction avec les acides pour produire une solution tamponée, ce qui signifie que le pH de la solution reste relativement stable. | |
| − | |||
| − | *.. | ||
| − | |||
| − | |||
<!-- ******** Fin Définition Générale ***************************** --> | <!-- ******** Fin Définition Générale ***************************** --> | ||
| Ligne 60 : | Ligne 56 : | ||
|Typologie= <!------------------------------------ Ne pas Modifier --> | |Typologie= <!------------------------------------ Ne pas Modifier --> | ||
<!-- ****************** Commercez les modifications ****************--> | <!-- ****************** Commercez les modifications ****************--> | ||
| − | *.... | + | *Acides minéraux et acides organiques : Les acides minéraux sont des acides inorganiques tels que l'acide sulfurique et l'acide chlorhydrique, tandis que les acides organiques sont des acides organiques tels que l'acide acétique et l'acide citrique. |
| − | + | *Acides forts et acides faibles : Les acides forts dissocient complètement en ions hydronium en solution, tandis que les acides faibles dissocient peu en ions hydronium. Les acides forts ont un pKa (constante d'acidité) inférieur à 1, tandis que les acides faibles ont un pKa supérieur à 1. | |
| − | + | *Acides monoprotiques et diprotiques : Les acides monoprotiques n'ont qu'un groupe acide dissociable (un proton), tandis que les acides diprotiques en ont deux. Par exemple, l'acide sulfurique est un acide diprotique, tandis que l'acide acétique est un acide monoprotique. | |
| − | . | + | *Acides oxydants et réducteurs : Les acides oxydants sont des acides qui peuvent oxyder les autres substances chimiques en retirant des électrons, tandis que les réducteurs sont des acides qui peuvent réduire les autres substances chimiques en leur donnant des électrons. |
| − | * | + | *Bases minérales et organiques : Les bases minérales sont des bases inorganiques telles que le sodium hydroxide (NaOH) et le potassium hydroxide (KOH), tandis que les bases organiques sont des bases organiques telles que l'amide et l'amine. |
| − | . | + | *Bases fortes et faibles : Les bases fortes dissocient complètement en ions hydroxyle en solution, tandis que les bases faibles dissocient peu en ions hydroxyle. Les bases fortes ont un pKa (constante d'acidité) supérieur à 14, tandis que les bases faibles ont un pKa inférieur à 14. |
| − | + | *Bases Lewis et bases Arrhenius : Les bases Lewis sont des bases qui acceptent des électrons et donc peuvent former des liaisons covalentes avec les acides, tandis que les bases Arrhenius sont des bases qui dissocient en ions hydroxyle dans les solutions aqueuses. | |
| + | *Bases amphotères : Les bases amphotères sont des substances qui peuvent se comporter comme des acides ou des bases en fonction des conditions chimiques. Par exemple, l'eau peut être considérée comme une base en raison de la présence d'ions hydroxyle (OH-), mais elle peut également se comporter comme un acide en raison de la présence d'ions hydronium (H3O+). | ||
| + | |||
}}<!-- ******** Fin Fiche Didactique Définition ******************* --> | }}<!-- ******** Fin Fiche Didactique Définition ******************* --> | ||
== {{Widget:Definition-graphique-Fiche}} == | == {{Widget:Definition-graphique-Fiche}} == | ||
| − | + | {{cc}} [https://cmapscloud.ihmc.us/viewer/cmap/1YXYB62DB-14K89XX-11P11PV Carte conceptuelle : Acide-Base] | |
<!-- ************************* Début ****************************** --> | <!-- ************************* Début ****************************** --> | ||
{{Fiche Didactique Media <!-------------------------------------------> | {{Fiche Didactique Media <!-------------------------------------------> | ||
| Ligne 109 : | Ligne 107 : | ||
<!----------------- Commencez les modifications des Mots Clés ---------------------> | <!----------------- Commencez les modifications des Mots Clés ---------------------> | ||
| − | |Mot-Clé-1= | + | |Mot-Clé-1= Propriétés chimiques |
| − | |Mot-Clé-2= | + | |Mot-Clé-2= Constante d'acidité (pKa) |
| − | |Mot-Clé-3= | + | |Mot-Clé-3= Réaction d'acid-base |
| − | |Mot-Clé-4= | + | |Mot-Clé-4= Equilibre acide-base |
| − | |Mot-Clé-5= | + | |Mot-Clé-5= Equation de réaction d'acide-base |
| − | |Mot-Clé-6= | + | |Mot-Clé-6= Neutralisation |
| − | |Mot-Clé-7= | + | |Mot-Clé-7= pH |
| − | |Mot-Clé-8= | + | |Mot-Clé-8= Constante de basicité (Pkb) |
| − | |Mot-Clé-9= | + | |Mot-Clé-9= Dosage acido-basique |
| − | |Mot-Clé-10= | + | |Mot-Clé-10= Dosage volumétrique |
}}<!-- ********************* FIN Fiche Didactique Mots-clés *******************--> | }}<!-- ********************* FIN Fiche Didactique Mots-clés *******************--> | ||
| − | |||
= {{Widget:Exemples-applications-utilisations-Fiche}} = | = {{Widget:Exemples-applications-utilisations-Fiche}} = | ||
| Ligne 133 : | Ligne 130 : | ||
<!-- ****************** Commercez les modifications *********************** --> | <!-- ****************** Commercez les modifications *********************** --> | ||
| − | * | + | *Chimie industrielle : Les acides et les bases sont utilisés dans un grand nombre de réactions chimiques industrielles, telles que la production de sels, de médicaments, de produits de nettoyage, de produits alimentaires et de produits de papeterie. |
| − | . | + | *Alimentation : Les acides et les bases sont présents dans de nombreux aliments, tels que les fruits et les légumes, et peuvent affecter le pH de notre corps. Les boissons alcalines, comme l'eau alcaline, sont également populaires en raison de leur capacité à aider à maintenir un pH sain dans le corps. |
| − | + | *Métallurgie : Les acides sont utilisés pour éliminer les impuretés dans les métaux, tandis que les bases sont utilisées pour neutraliser les acides et pour contrôler le pH des solutions utilisées dans la production de métaux. | |
| − | + | *Énergie : Les acides et les bases sont utilisés dans les batteries pour stocker et transférer de l'énergie électrique. | |
| − | * | + | *Santé : Les acides et les bases sont utilisés en médecine pour ajuster le pH des fluides corporels et traiter les conditions médicales telles que l'acidose et l'alcalose. |
| − | + | *Agriculture : Les acides et les bases sont utilisés dans l'agriculture pour contrôler le pH des sols et favoriser la croissance des plantes. | |
| − | |||
| − | |||
}}<!--************** Fin Fiche Didactique Explicitations ******************* --> | }}<!--************** Fin Fiche Didactique Explicitations ******************* --> | ||
| − | |||
= {{Widget:Erreurs-confusions-Fiche}} = | = {{Widget:Erreurs-confusions-Fiche}} = | ||
| Ligne 155 : | Ligne 149 : | ||
{{@}} '''Erreur: Croire que''' | {{@}} '''Erreur: Croire que''' | ||
| − | * | + | * Le ph d'un acide est élevé implique que l'acide est fort. |
| − | * | + | * l'acide est plus dangereux que la base. |
{{@}} '''Confusion possible ou glissement de sens''' | {{@}} '''Confusion possible ou glissement de sens''' | ||
| − | * Confusion entre [[ | + | * Confusion entre [[ph de la base - ph de l'acide]] |
| − | * Confusion entre [[ | + | * Confusion entre [[l'ionisation de la base - l'ionisation de l'acide]] |
{{@}} '''Erreur fréquente''': | {{@}} '''Erreur fréquente''': | ||
| − | * | + | * Pour préparer une solution diluée d'un acide ou d'une base, il faut impérativement verser de l'acide ou de la base dans l'eau et ne pas l'inverse. |
}}<!-- ************** Fin Fiche Didactique Conceptions ********************* --> | }}<!-- ************** Fin Fiche Didactique Conceptions ********************* --> | ||
| Ligne 176 : | Ligne 170 : | ||
<!-- ************ Commercez les modifications *********************--> | <!-- ************ Commercez les modifications *********************--> | ||
| − | * [[ | + | * [[Comment l'équilibre acide-base est-il maintenu dans le corps]]? |
| − | * [[ | + | * [[Comment l'environnement peut-il être affecté par l'augmentation de la concentration d'acides dans l'air et dans l'eau]]? |
| − | * [[ | + | * [[Comment les sols acides ou basiques peuvent-ils affecter la croissance des plantes]]? |
}}<!-- ******** Fin Fiche Didactique Questions ******************* --> | }}<!-- ******** Fin Fiche Didactique Questions ******************* --> | ||
Version actuelle datée du 25 février 2023 à 10:03
 Traduction
Traduction
 Définition
Définition
Domaine, Discipline, Thématique
Définition écrite
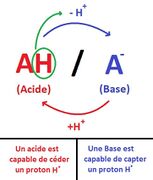
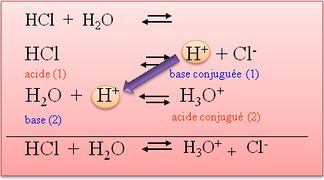
- Un acide est une substance chimique qui a une teneur élevée en ions hydronium (H3O+) en solution. Les acides peuvent réagir avec les bases pour former des sels et de l'eau. Les acides sont souvent décrits comme ayant un goût aigre et une réaction avec des métaux pour produire des gaz comme le dioxyde de carbone ou de l'hydrogène.
- Une base est une substance chimique différente d'un acide. Les bases ont une teneur élevée en ions hydroxyle (OH-) en solution et peuvent réagir avec les acides pour former des sels et de l'eau. Les bases sont souvent décrites comme ayant un goût alcalin et une réaction avec les acides pour produire une solution tamponée, ce qui signifie que le pH de la solution reste relativement stable.
|
Définition graphique
![]() Carte conceptuelle : Acide-Base
Carte conceptuelle : Acide-Base
 Concepts ou notions associés
Concepts ou notions associés
 Exemples, applications, utilisations
Exemples, applications, utilisations
|
 Erreurs ou confusions éventuelles
Erreurs ou confusions éventuelles
- Le ph d'un acide est élevé implique que l'acide est fort.
- l'acide est plus dangereux que la base.
![]() Confusion possible ou glissement de sens
Confusion possible ou glissement de sens
- Confusion entre ph de la base - ph de l'acide
- Confusion entre l'ionisation de la base - l'ionisation de l'acide
- Pour préparer une solution diluée d'un acide ou d'une base, il faut impérativement verser de l'acide ou de la base dans l'eau et ne pas l'inverse.
 Questions possibles
Questions possibles
 Liaisons enseignements et programmes
Liaisons enseignements et programmes
Idées ou Réflexions liées à son enseignement
Aides et astuces
Education: Autres liens, sites ou portails
 Bibliographie
Bibliographie
Pour citer cette page: (et Bases)
ABROUGUI, M & al, 2023. Acides et Bases. In Didaquest [en ligne]. <http:www.didaquest.org/wiki/Acides_et_Bases>, consulté le 10, mai, 2025
- ..................
- ..................
- ..................
- ..................
Catégories :
- Sponsors Education
- Chimie organique (Concepts)
- Chimie minérale (Concepts)
- Chimie pharmacetique (Concepts)
- Industrie Alimentaire (Concepts)
- Détergeant (Concepts)
- Cosmétique (Concepts)
- Anatomie (Concepts)
- Propriétés chimiques
- Constante d'acidité (pKa)
- Réaction d'acid-base
- Equilibre acide-base
- Equation de réaction d'acide-base
- Neutralisation
- PH
- Constante de basicité (Pkb)
- Dosage acido-basique
- Dosage volumétrique
- Concepts
- Acides et Bases
- Acides et Bases (Concepts)
- Fiche conceptuelle didactique