Différences entre versions de « Liaison covalente »
(Page créée avec « {{widget:HautFicheConceptuelle}} {{widget:PBEducation}}<!-- La syntaxe suivante ne doit pas être modifiée--> = {{Widget:Traduction-Fiche}} = Liaison covalente (Fra... ») |
|||
| (5 versions intermédiaires par le même utilisateur non affichées) | |||
| Ligne 17 : | Ligne 17 : | ||
<!-- Remplacer et adapter le contenu --> | <!-- Remplacer et adapter le contenu --> | ||
| − | * La liaison covalente est la mise en commun de 2 [[électrons]] célibataires entre 2 [[atomes]]. | + | * La liaison covalente est la mise en commun de 2 [[électrons]] célibataires entre 2 [[atomes]].Elle peut être simple ou double ou triple |
* Autre Définition : | * Autre Définition : | ||
| Ligne 24 : | Ligne 24 : | ||
* | * | ||
| − | 1.a Liaison covalente normale parfaite normale : il s'agit d'une mise en commun de 2 électrons célibataires et parfaite entre 2 atomes de | + | 1.a Liaison covalente normale parfaite normale : il s'agit d'une mise en commun de 2 électrons célibataires et parfaite entre 2 atomes de même [[électronégativité]] |
| − | 1.b Liaison covalente normale polarisée résulte de la mise en commun de 2 électrons célibataires (covalente) entre 2 atomes d'électronégativités | + | 1.b Liaison covalente normale polarisée résulte de la mise en commun de 2 électrons célibataires (covalente) entre 2 atomes d'électronégativités differentes (polarisée). |
2. Liaison covalente dative : elle résulte de la mise en commun d'une paire d'électrons (covalente) entre 2 atomes d'électronégativité différente. L'atome le plus moins électronégatif donne une paire d'électrons (dative). | 2. Liaison covalente dative : elle résulte de la mise en commun d'une paire d'électrons (covalente) entre 2 atomes d'électronégativité différente. L'atome le plus moins électronégatif donne une paire d'électrons (dative). | ||
{{Widget:Fin-cadre-Bleu}} | {{Widget:Fin-cadre-Bleu}} | ||
| − | |||
== {{Widget:Definition-graphique-Fiche}} == | == {{Widget:Definition-graphique-Fiche}} == | ||
| Ligne 41 : | Ligne 40 : | ||
[[Fichier:liaisonscovalentes2.gif |200 px|Liaison covalente normale polarisée]]<!-- Remplacer et adapter le contenu --> | [[Fichier:liaisonscovalentes2.gif |200 px|Liaison covalente normale polarisée]]<!-- Remplacer et adapter le contenu --> | ||
[[Fichier:liaisonscovalentes2.gif |200 px|Liaison covalente normale dative]]<!-- Remplacer et adapter le contenu --> | [[Fichier:liaisonscovalentes2.gif |200 px|Liaison covalente normale dative]]<!-- Remplacer et adapter le contenu --> | ||
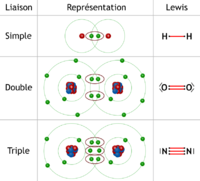
| − | + | [[Fichier:liaisons simple double triple.png |200 px|liaisons simple double triple]]<!-- Remplacer et adapter le contenu --> | |
{{Widget:Fin-cadre-Bleu}} | {{Widget:Fin-cadre-Bleu}} | ||
| Ligne 50 : | Ligne 49 : | ||
<!-- Remplacer et adapter le contenu --> | <!-- Remplacer et adapter le contenu --> | ||
| − | [[électrons]] / [[ | + | [[électrons]] / [[atome]]/[[électronégativité]] |
| Ligne 57 : | Ligne 56 : | ||
= {{Widget:Exemples-applications-utilisations-Fiche}} = | = {{Widget:Exemples-applications-utilisations-Fiche}} = | ||
| − | * | + | * Deux atomes de chlore vont partager un seul doublet d'électrons partagés pour former la molécule Cl2 |
| − | * .. | + | * Un atome d'oxygène partagera deux doublets d'électrons avec un atome de carbone. Ainsi, lorsque deux atomes d'oxygène vont partager des électrons avec le carbone, la molécule formée sera CO2. |
| − | |||
= {{Widget:Erreurs-confusions-Fiche}} = | = {{Widget:Erreurs-confusions-Fiche}} = | ||
| − | * | + | *Il y a des confusions entre liaison covalente dative et liaison ionique qui est un transfert d'électrons d'un atome à un autre. |
| − | |||
= {{Widget:Questions-possibles-Fiche}} = | = {{Widget:Questions-possibles-Fiche}} = | ||
| − | * Question:. | + | * Question:Définir la liaison covalente. |
| − | + | Quels sont les types de liaisons covalentes ? | |
| + | Est-ce qu'une liaison covalente double peut être dative ? | ||
= {{Widget:Liens-enseignement-Fiche}} = | = {{Widget:Liens-enseignement-Fiche}} = | ||
| Ligne 79 : | Ligne 77 : | ||
= {{Widget:Aides-astuces-Fiche}} = | = {{Widget:Aides-astuces-Fiche}} = | ||
| + | 1. Les liaisons entre O sont à éviter, car peu stables. | ||
| + | 2. Les liaisons entre O et H se forment très facilement | ||
| + | 3. La liaison ionique est utilisée si un des atomes de la molécule ne réalise pas l'octet. Elle se rencontrera dans les molécules contenant un métal. | ||
| + | 4. Les liaisons entre C (carbone) se font très facilement, ils peuvent être unis de façon simple, double voire triple. | ||
| + | 5. Dans certains cas, la combinaison de deux types de liaison peut être possible. ( ex : liaison ionique et covalente dans la molécule de HNO2). | ||
= {{Widget:Difficultes-enseignement-Fiche}} = | = {{Widget:Difficultes-enseignement-Fiche}} = | ||
| − | + | Lorsqu'il y a plus de deux éléments intervenant dans la molécule, il peut être difficile de représenter leur liaison (formule de structure). | |
= {{Widget:Liens-internet-Fiche}} = | = {{Widget:Liens-internet-Fiche}} = | ||
Version actuelle datée du 26 janvier 2017 à 20:24
 Traduction
Traduction
Liaison covalente (Français) / covalent bond (Anglais) / الرابطة التساهمية (Arabe)
 Définition
Définition
- Domaine, Discipline, Thématique :
Catégorie: Sciences physiques / Catégorie: Chimie / Catégorie: la matière
Définition écrite
Une Liaison covalente correspond au partage d'une paire d'électrons. Les atomes mettent en commun en électron afin de créer un doublet d'électrons qui les relient alors. Il s'agit donc d'une liaison chimique. 1.a Liaison covalente normale parfaite normale : il s'agit d'une mise en commun de 2 électrons célibataires et parfaite entre 2 atomes de même électronégativité 1.b Liaison covalente normale polarisée résulte de la mise en commun de 2 électrons célibataires (covalente) entre 2 atomes d'électronégativités differentes (polarisée). 2. Liaison covalente dative : elle résulte de la mise en commun d'une paire d'électrons (covalente) entre 2 atomes d'électronégativité différente. L'atome le plus moins électronégatif donne une paire d'électrons (dative). |
Définition graphique
 Concepts ou notions associés
Concepts ou notions associés
 Exemples, applications, utilisations
Exemples, applications, utilisations
- Deux atomes de chlore vont partager un seul doublet d'électrons partagés pour former la molécule Cl2
- Un atome d'oxygène partagera deux doublets d'électrons avec un atome de carbone. Ainsi, lorsque deux atomes d'oxygène vont partager des électrons avec le carbone, la molécule formée sera CO2.
 Erreurs ou confusions éventuelles
Erreurs ou confusions éventuelles
- Il y a des confusions entre liaison covalente dative et liaison ionique qui est un transfert d'électrons d'un atome à un autre.
 Questions possibles
Questions possibles
- Question:Définir la liaison covalente.
Quels sont les types de liaisons covalentes ? Est-ce qu'une liaison covalente double peut être dative ?
 Liaisons enseignements et programmes
Liaisons enseignements et programmes
- Portail Formation Gratuite
- Multisites Educatifs
- Sur DidaQuest
- Sur le Portail Didactique.info
- Sur le Portail Questions / Réponses
- Concept Sur Wikipedia
- Concept Sur Wikiwand
- Concept Sur Wikiversity
 Aides, Astuces,...
Aides, Astuces,...
1. Les liaisons entre O sont à éviter, car peu stables. 2. Les liaisons entre O et H se forment très facilement 3. La liaison ionique est utilisée si un des atomes de la molécule ne réalise pas l'octet. Elle se rencontrera dans les molécules contenant un métal. 4. Les liaisons entre C (carbone) se font très facilement, ils peuvent être unis de façon simple, double voire triple. 5. Dans certains cas, la combinaison de deux types de liaison peut être possible. ( ex : liaison ionique et covalente dans la molécule de HNO2).
=
 Difficultés liées à son enseignement =
Lorsqu'il y a plus de deux éléments intervenant dans la molécule, il peut être difficile de représenter leur liaison (formule de structure).
Difficultés liées à son enseignement =
Lorsqu'il y a plus de deux éléments intervenant dans la molécule, il peut être difficile de représenter leur liaison (formule de structure).
 Liens Internet
Liens Internet
- URL :
- URL :