Différences entre versions de « Spectre atomique »
| (6 versions intermédiaires par le même utilisateur non affichées) | |||
| Ligne 17 : | Ligne 17 : | ||
<!-- Remplacer et adapter le contenu --> | <!-- Remplacer et adapter le contenu --> | ||
| − | Quand on excite des atomes d’un tube à décharge ou d’un arc électrique il | + | Quand on excite des atomes d’un tube à décharge ou d’un arc électrique il y a émission d'un [[rayonnement]] ou [[radiation]] qui est dispersé à l’aide d’un prisme ou d’un réseau, le rayonnement peut être examiné en fonction de la [[longueur d’onde]], de la fréquence ou de l’[[énergie]] d’un quantum. ce qu' |
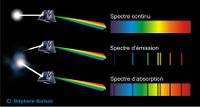
| − | Contrairement au spectre continue de la lumière blanche les spectres obtenus ne contiennent que certaines fréquences : ils sont appelés spectres de raies. | + | Contrairement au spectre continue de la lumière blanche les spectres obtenus ne contiennent que certaines fréquences : ils sont appelés spectres de [[raies]]. |
| − | Tous les spectres obtenus de cette façon montrent que le rayonnement est formé de plusieurs raies spectrales étroites qui apparaissent sur des diagrammes complexes. Elles sont caractéristiques de | + | Tous les spectres obtenus de cette façon montrent que le rayonnement est formé de plusieurs raies spectrales étroites qui apparaissent sur des diagrammes complexes. Elles sont caractéristiques de l’[[élément]] et les atomes sont responsables de l’émission. Pour émettre le spectre atomique, une substance doit contenir des atomes libres. Le spectre de l’atome d’hydrogène est relativement simple et a été à la base des premières interprétations théoriques. |
| − | spectre atomique, une substance doit contenir des atomes libres. Le spectre de l’atome d’hydrogène est relativement simple et a été à la base des premières interprétations théoriques. | ||
Les spectres atomiques sont de deux types : absorption et émission. | Les spectres atomiques sont de deux types : absorption et émission. | ||
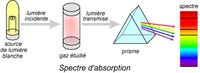
Spectres d’absorption : | Spectres d’absorption : | ||
Le spectre d'absorption est un spectre discontinu formé par des raies noires (cannelures) sur un fond coloré qui correspond au spectre visible de la lumière blanche. | Le spectre d'absorption est un spectre discontinu formé par des raies noires (cannelures) sur un fond coloré qui correspond au spectre visible de la lumière blanche. | ||
| − | La lumière traverse un échantillon (dans son état fondamental) et on observe à l’issue de cette traversée un spectre d’absorption. | + | La lumière traverse un échantillon (dans son [[état fondamental]]) et on observe à l’issue de cette traversée un spectre d’absorption. |
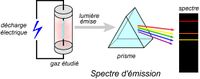
Spectres d’émission : | Spectres d’émission : | ||
Le spectre d'émission est un spectre discontinu formé par des raies colorées sur un fond noir. | Le spectre d'émission est un spectre discontinu formé par des raies colorées sur un fond noir. | ||
On excite la matière qui émet, pour retourner à son état stable, une lumière. | On excite la matière qui émet, pour retourner à son état stable, une lumière. | ||
| − | + | ||
{{Widget:Fin-cadre-Bleu}} | {{Widget:Fin-cadre-Bleu}} | ||
| − | |||
== {{Widget:Definition-graphique-Fiche}} == | == {{Widget:Definition-graphique-Fiche}} == | ||
| Ligne 54 : | Ligne 52 : | ||
<!-- Remplacer et adapter le contenu --> | <!-- Remplacer et adapter le contenu --> | ||
| − | + | [[rayonnement]] / [[radiation]] / [[longueur d’onde]] / [[énergie]] / [[raies]] / [[état fondamental]] | |
{{Widget:Fin-cadre-Bleu}} | {{Widget:Fin-cadre-Bleu}} | ||
| Ligne 68 : | Ligne 66 : | ||
= {{Widget:Erreurs-confusions-Fiche}} = | = {{Widget:Erreurs-confusions-Fiche}} = | ||
| − | * | + | * il faut distinguer entre le spectre d'absorption et d'emission |
| − | * . | + | *Pour trouver le nombre de raies que l’on peut créer pour un nombre de niveaux donnés quand il n’y a pas de transition interdite beaucoup d’éleves ajoutent un niveau chaque fois qu’ils veulent créer une raie. |
| + | L'énergie ici est négative alors que pour eux c'est une grandeur positive | ||
| + | |||
= {{Widget:Questions-possibles-Fiche}} = | = {{Widget:Questions-possibles-Fiche}} = | ||
| − | * | + | * Questions: |
| − | + | Qu'elle est la différence entre un spectre atomique d’émission et un spectre d'absorption ? | |
| + | Comment un electron peut il passer d'un niveau énergétique à l'autre et revenir à son état fondamental? | ||
| + | Que se passe t il à l'atome si on lui fournit une énergie supérieure à son énergie d'ionisation? | ||
= {{Widget:Liens-enseignement-Fiche}} = | = {{Widget:Liens-enseignement-Fiche}} = | ||
| Ligne 83 : | Ligne 85 : | ||
= {{Widget:Aides-astuces-Fiche}} = | = {{Widget:Aides-astuces-Fiche}} = | ||
| − | + | calculer les énergies des raies ce qui oblige les eleves à « s’approprier » la formule | |
| + | A partir de la formule de Rydberg et du schéma des niveaux, on pourrait identifier le numéro de niveau | ||
| + | avec le nombre quantique principal. Dans ce cas, on obtiendrait l’énergie des niveaux et la limite de | ||
| + | dissociation pour n = +∞. | ||
= {{Widget:Difficultes-enseignement-Fiche}} = | = {{Widget:Difficultes-enseignement-Fiche}} = | ||
| + | Il est difficile d'introduire la discontinuité de l'énergie. | ||
| + | Le modèle utilisé pose une difficulté chez les élèves car ils ont une conception du modèle de Rutherford et Bohr de l'atome | ||
| + | il est difficile de montrer la nécessité de définir une origine des énergies. | ||
| + | la relation de Balmer-Rydberg ne fait pas intervenir le niveau fondamental. | ||
= {{Widget:Liens-internet-Fiche}} = | = {{Widget:Liens-internet-Fiche}} = | ||
| Ligne 102 : | Ligne 111 : | ||
[[Category:Domaine ou Thématique ou Discipline]] | [[Category:Domaine ou Thématique ou Discipline]] | ||
[[Category: Fiches didactiques]] | [[Category: Fiches didactiques]] | ||
| − | [[Category:Superviseur Arbi | + | [[Category:Superviseur Ali Arbi]] |
| + | [[Category: Superviseur]] | ||
Version actuelle datée du 27 janvier 2017 à 12:43
 Traduction
Traduction
Spectre atomique (Français) / Atomic spectrum (Anglais) / الطيف الذري (Arabe)
 Définition
Définition
- Domaine, Discipline, Thématique :
Catégorie: Sciences physiques / Catégorie: Physique / Catégorie: Physique atomique nucéaire
Définition écrite
|
Les spectres atomiques sont de deux types : absorption et émission. Spectres d’absorption : Le spectre d'absorption est un spectre discontinu formé par des raies noires (cannelures) sur un fond coloré qui correspond au spectre visible de la lumière blanche. La lumière traverse un échantillon (dans son état fondamental) et on observe à l’issue de cette traversée un spectre d’absorption. Spectres d’émission : Le spectre d'émission est un spectre discontinu formé par des raies colorées sur un fond noir. On excite la matière qui émet, pour retourner à son état stable, une lumière.
|
Définition graphique
 Concepts ou notions associés
Concepts ou notions associés
 Exemples, applications, utilisations
Exemples, applications, utilisations
- Spectre de l’atome d’hydrogène :
Sous l’effet du champ électrique intense crée entre les électrodes de l’ampoule, l’atome d’hydrogène subit une déformation due aux forces opposées qui s’exercent simultanément sur l’électron et le proton. Le champ électrique fournit alors de l’énergie à l’atome d’hydrogène ce qui permet à l’électron de passer du niveau E1 au niveau supérieur Ei , l’atome passe alors de son état fondamental à un état excité qui est instable . L'état excité n'est pas un état stable pour l'atome, il n'y reste que pour un court instant environ égal à 10^-8 s. On remarque que ce spectre comporte des raies noires dont les longueurs d'ondes sont identiques à celles présentes dans le spectre d'émission du même gaz.
 Erreurs ou confusions éventuelles
Erreurs ou confusions éventuelles
- il faut distinguer entre le spectre d'absorption et d'emission
- Pour trouver le nombre de raies que l’on peut créer pour un nombre de niveaux donnés quand il n’y a pas de transition interdite beaucoup d’éleves ajoutent un niveau chaque fois qu’ils veulent créer une raie.
L'énergie ici est négative alors que pour eux c'est une grandeur positive
 Questions possibles
Questions possibles
- Questions:
Qu'elle est la différence entre un spectre atomique d’émission et un spectre d'absorption ? Comment un electron peut il passer d'un niveau énergétique à l'autre et revenir à son état fondamental? Que se passe t il à l'atome si on lui fournit une énergie supérieure à son énergie d'ionisation?
 Liaisons enseignements et programmes
Liaisons enseignements et programmes
- Portail Formation Gratuite
- Multisites Educatifs
- Sur DidaQuest
- Sur le Portail Didactique.info
- Sur le Portail Questions / Réponses
- Concept Sur Wikipedia
- Concept Sur Wikiwand
- Concept Sur Wikiversity
 Aides, Astuces,...
Aides, Astuces,...
calculer les énergies des raies ce qui oblige les eleves à « s’approprier » la formule A partir de la formule de Rydberg et du schéma des niveaux, on pourrait identifier le numéro de niveau avec le nombre quantique principal. Dans ce cas, on obtiendrait l’énergie des niveaux et la limite de dissociation pour n = +∞.
=
 Difficultés liées à son enseignement =
Difficultés liées à son enseignement =
Il est difficile d'introduire la discontinuité de l'énergie. Le modèle utilisé pose une difficulté chez les élèves car ils ont une conception du modèle de Rutherford et Bohr de l'atome il est difficile de montrer la nécessité de définir une origine des énergies. la relation de Balmer-Rydberg ne fait pas intervenir le niveau fondamental.
 Liens Internet
Liens Internet
- URL :
- URL :