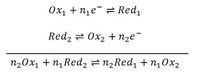Différences entre versions de « L'équation globale de l'oxydoréduction »
De Didaquest
Aller à la navigationAller à la recherche (Page créée avec « {{widget:HautFicheConceptuelle}} {{widget:PBEducation}}<!-- La syntaxe suivante ne doit pas être modifiée--> = {{Widget:Traduction-Fiche}} = L'équation globale de l... ») |
|||
| (3 versions intermédiaires par le même utilisateur non affichées) | |||
| Ligne 33 : | Ligne 33 : | ||
<!-- Remplacer et adapter le contenu --> | <!-- Remplacer et adapter le contenu --> | ||
[[Fichier:rdx01.jpg |200 px|Titre de la définition graphique 1]]<!-- Remplacer et adapter le contenu --> | [[Fichier:rdx01.jpg |200 px|Titre de la définition graphique 1]]<!-- Remplacer et adapter le contenu --> | ||
| − | [[Fichier: | + | [[Fichier:rdx02.jpg |200 px|Titre de la définition graphique 2]]<!-- Remplacer et adapter le contenu --> |
| − | [[Fichier: | + | [[Fichier:rdx03.jpg |200 px|Titre de la définition graphique 3]]<!-- Remplacer et adapter le contenu --> |
{{Widget:Fin-cadre-Bleu}} | {{Widget:Fin-cadre-Bleu}} | ||
| Ligne 76 : | Ligne 76 : | ||
Un échange d'électrons entre des réactifs a toujours lieu dans une réaction d'oxydoréduction. Ainsi, le réactif qui gagne des électrons est nommé oxydant puisqu'il cause l'oxydation d'une autre substance. À l'inverse, le réactif qui perd des électrons est nommé réducteur puisqu'il cause la réduction de l'autre substance. | Un échange d'électrons entre des réactifs a toujours lieu dans une réaction d'oxydoréduction. Ainsi, le réactif qui gagne des électrons est nommé oxydant puisqu'il cause l'oxydation d'une autre substance. À l'inverse, le réactif qui perd des électrons est nommé réducteur puisqu'il cause la réduction de l'autre substance. | ||
= {{Widget:Difficultes-enseignement-Fiche}} = | = {{Widget:Difficultes-enseignement-Fiche}} = | ||
| − | + | * Difficultés liées à l'équilibre de charges et à l'équilibre de matière. | |
| + | * Manque de précision concernant les couples redox mis en jeu | ||
= {{Widget:Liens-internet-Fiche}} = | = {{Widget:Liens-internet-Fiche}} = | ||
| Ligne 92 : | Ligne 93 : | ||
[[Category:Domaine ou Thématique ou Discipline]] | [[Category:Domaine ou Thématique ou Discipline]] | ||
[[Category: Fiches didactiques]] | [[Category: Fiches didactiques]] | ||
| + | [[category: superviseur RTIMI ]] | ||
| + | [[category: superviseur ]] | ||
Version actuelle datée du 27 janvier 2017 à 12:44
 Traduction
Traduction
L'équation globale de l'oxydoréduction (Français) / The global equation of redox (Anglais) / المعادلة العامة للأكسدة (Arabe)
 Définition
Définition
- Domaine, Discipline, Thématique :
Catégorie: Chimie générale / Catégorie: Électrochimie / Catégorie: Métallurgie
Définition écrite
C'est la somme de deux demi-réactions, celle d'oxydation et celle de réduction au cours du quelle il y a un transfert d'électrons.
Dans une réaction d'oxydoréduction, l'oxydant et le réducteur forme un couple lié par un échange d'électrons |
Définition graphique
 Concepts ou notions associés
Concepts ou notions associés
 Exemples, applications, utilisations
Exemples, applications, utilisations
- Pile électrochimique
- Corrosion
 Erreurs ou confusions éventuelles
Erreurs ou confusions éventuelles
- A ne pas confondre la demi-réaction d'oxydation ou de réduction avec la demi réaction d'oxydoréduction
- On doit vérifier si le nombre d'électrons donnés est égal au nombre d’électrons reçus
 Questions possibles
Questions possibles
- Comment arrive-t-on à équilibrer l'équation totale de réaction redox?
- Comment procéder pour additionner les deux demi-équations de réactions en une seule équation?
 Liaisons enseignements et programmes
Liaisons enseignements et programmes
- Portail Formation Gratuite
- Multisites Educatifs
- Sur DidaQuest
- Sur le Portail Didactique.info
- Sur le Portail Questions / Réponses
- Concept Sur Wikipedia
- Concept Sur Wikiwand
- Concept Sur Wikiversity
 Aides, Astuces,...
Aides, Astuces,...
Un échange d'électrons entre des réactifs a toujours lieu dans une réaction d'oxydoréduction. Ainsi, le réactif qui gagne des électrons est nommé oxydant puisqu'il cause l'oxydation d'une autre substance. À l'inverse, le réactif qui perd des électrons est nommé réducteur puisqu'il cause la réduction de l'autre substance.
=
 Difficultés liées à son enseignement =
Difficultés liées à son enseignement =
- Difficultés liées à l'équilibre de charges et à l'équilibre de matière.
- Manque de précision concernant les couples redox mis en jeu
 Liens Internet
Liens Internet
- URL :
- URL :