Différences entre versions de « ISOTOPE »
| (20 versions intermédiaires par le même utilisateur non affichées) | |||
| Ligne 16 : | Ligne 16 : | ||
<!-- Remplacer et adapter le contenu --> | <!-- Remplacer et adapter le contenu --> | ||
| − | + | ||
On appelle isotopes (d'un certain élément chimique) les nucléides partageant le même nombre de protons (caractéristique de cet élément), mais ayant un nombre de neutrons différent. Autrement dit, si l'on considère deux nucléides dont les nombres de protons sont Z et Z', et les nombres de neutrons N et N', ces nucléides sont dits isotopes si Z = Z' et N ≠ N'. | On appelle isotopes (d'un certain élément chimique) les nucléides partageant le même nombre de protons (caractéristique de cet élément), mais ayant un nombre de neutrons différent. Autrement dit, si l'on considère deux nucléides dont les nombres de protons sont Z et Z', et les nombres de neutrons N et N', ces nucléides sont dits isotopes si Z = Z' et N ≠ N'. | ||
| Ligne 22 : | Ligne 22 : | ||
Les isotopes ne doivent pas être confondus avec : | Les isotopes ne doivent pas être confondus avec : | ||
| − | les | + | les isotopes, nucléides ayant le même nombre de neutrons mais un nombre de protons différent (Z ≠ Z' mais N = N') ; |
les isobares, nucléides ayant des nombres de protons différents, des nombres de neutrons différents, mais des nombres de masse identiques (Z ≠ Z', N ≠ N', mais Z + N = A = A' = Z' + N') ; | les isobares, nucléides ayant des nombres de protons différents, des nombres de neutrons différents, mais des nombres de masse identiques (Z ≠ Z', N ≠ N', mais Z + N = A = A' = Z' + N') ; | ||
les isomères, nucléides ayant le même nombre de protons et le même nombre de neutrons (donc aussi le même nombre de masse) mais pas le même spin ni le même niveau énergétique. | les isomères, nucléides ayant le même nombre de protons et le même nombre de neutrons (donc aussi le même nombre de masse) mais pas le même spin ni le même niveau énergétique. | ||
| Ligne 32 : | Ligne 32 : | ||
{{Widget:Fin-cadre-Bleu}} | {{Widget:Fin-cadre-Bleu}} | ||
| + | == {{Widget:Definition-graphique-Fiche}} == | ||
| − | |||
| − | |||
<!-- Remplacer et adapter le contenu --> | <!-- Remplacer et adapter le contenu --> | ||
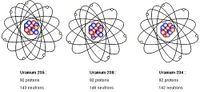
| − | [[Fichier:image_radioactivite_isotopes--uranium | + | [[Fichier:image_radioactivite_isotopes--uranium.JPG|200 px|Titre de la définition graphique 1]] |
| − | |||
| − | |||
| − | |||
| − | |||
= {{Widget:Concepts-notions-associes-Fiche}} = | = {{Widget:Concepts-notions-associes-Fiche}} = | ||
| Ligne 51 : | Ligne 46 : | ||
<!-- Remplacer et adapter le contenu --> | <!-- Remplacer et adapter le contenu --> | ||
| − | [[ | + | [[Nucléide1]] / [[Proton1]] / [[Neutron1]] / [[Spin1]] / [[Etat énérgitique1]] |
{{Widget:Fin-cadre-Bleu}} | {{Widget:Fin-cadre-Bleu}} | ||
| + | Exemple : L'élément chlore (Z=17) possède 2 isotopes : le chlore 35 ayant 18 neutrons et le chlore 37 ayant 20 neutrons. le 12C, le 13C et le 14C sont trois isotopes du carbone, car ils possèdent tous 6 protons. | ||
| + | |||
| + | |||
| + | Exemple: l'hydrogène. Il existe d'autres atomes qui ont les mêmes propriétés chimiques que l'élément hydrogène. Ils ont le même nombre de protons et d'électrons, mais leurs nombres de neutrons sont différents. | ||
= {{Widget:Exemples-applications-utilisations-Fiche}} = | = {{Widget:Exemples-applications-utilisations-Fiche}} = | ||
| + | * C12, C13, C14 | ||
* .... | * .... | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
= {{Widget:Questions-possibles-Fiche}} = | = {{Widget:Questions-possibles-Fiche}} = | ||
* Question:..... | * Question:..... | ||
| − | |||
= {{Widget:Liens-enseignement-Fiche}} = | = {{Widget:Liens-enseignement-Fiche}} = | ||
| Ligne 85 : | Ligne 78 : | ||
= {{Widget:Liens-internet-Fiche}} = | = {{Widget:Liens-internet-Fiche}} = | ||
| − | * '''URL''' : | + | * '''URL''' : https://prmarchenry.blogspot.com/2014/03/isotopes.html |
| − | * '''URL''' : | + | * '''URL''' :https://fr.wikipedia.org/wiki/M%C3%A9decine_nucl%C3%A9aire |
| − | + | * '''URL''' :http://www.universalis.fr/encyclopedie/isotopes-biologie/2-isotopes-en-medecine/ | |
= {{Widget:Bibliographie-Fiche}} = | = {{Widget:Bibliographie-Fiche}} = | ||
| Ligne 97 : | Ligne 90 : | ||
[[Category:Domaine ou Thématique ou Discipline]] | [[Category:Domaine ou Thématique ou Discipline]] | ||
[[Category: Fiches didactiques]] | [[Category: Fiches didactiques]] | ||
| + | [[Category:Superviseur Mimouni Jamila]] | ||
Version actuelle datée du 3 février 2017 à 13:13
 Traduction
Traduction
Isotope (Français) / Isotope (Anglais) / النظائر (Arabe)
 Définition
Définition
- Domaine, Discipline, Thématique :
Catégorie: Chimie / Catégorie: physique nucléaire
Définition écrite
|
On appelle isotopes (d'un certain élément chimique) les nucléides partageant le même nombre de protons (caractéristique de cet élément), mais ayant un nombre de neutrons différent. Autrement dit, si l'on considère deux nucléides dont les nombres de protons sont Z et Z', et les nombres de neutrons N et N', ces nucléides sont dits isotopes si Z = Z' et N ≠ N'. Les isotopes ne doivent pas être confondus avec : les isotopes, nucléides ayant le même nombre de neutrons mais un nombre de protons différent (Z ≠ Z' mais N = N') ; les isobares, nucléides ayant des nombres de protons différents, des nombres de neutrons différents, mais des nombres de masse identiques (Z ≠ Z', N ≠ N', mais Z + N = A = A' = Z' + N') ; les isomères, nucléides ayant le même nombre de protons et le même nombre de neutrons (donc aussi le même nombre de masse) mais pas le même spin ni le même niveau énergétique.
|
Définition graphique
 Concepts ou notions associés
Concepts ou notions associés
|
|
Exemple : L'élément chlore (Z=17) possède 2 isotopes : le chlore 35 ayant 18 neutrons et le chlore 37 ayant 20 neutrons. le 12C, le 13C et le 14C sont trois isotopes du carbone, car ils possèdent tous 6 protons.
Exemple: l'hydrogène. Il existe d'autres atomes qui ont les mêmes propriétés chimiques que l'élément hydrogène. Ils ont le même nombre de protons et d'électrons, mais leurs nombres de neutrons sont différents.
 Exemples, applications, utilisations
Exemples, applications, utilisations
- C12, C13, C14
- ....
 Questions possibles
Questions possibles
- Question:.....
 Liaisons enseignements et programmes
Liaisons enseignements et programmes
- Portail Formation Gratuite
- Multisites Educatifs
- Sur DidaQuest
- Sur le Portail Didactique.info
- Sur le Portail Questions / Réponses
- Concept Sur Wikipedia
- Concept Sur Wikiwand
- Concept Sur Wikiversity
 Aides, Astuces,...
Aides, Astuces,...
=
 Difficultés liées à son enseignement =
Difficultés liées à son enseignement =
 Liens Internet
Liens Internet
- URL : https://prmarchenry.blogspot.com/2014/03/isotopes.html
- URL :https://fr.wikipedia.org/wiki/M%C3%A9decine_nucl%C3%A9aire
- URL :http://www.universalis.fr/encyclopedie/isotopes-biologie/2-isotopes-en-medecine/