Différences entre versions de « Notion de pH »
| Ligne 28 : | Ligne 28 : | ||
<!--****************** Commercez les modifications: Fiche-Disciplines-Thématiques *********************--> | <!--****************** Commercez les modifications: Fiche-Disciplines-Thématiques *********************--> | ||
| − | |Domaine-Discipline-Thématique-1= | + | |Domaine-Discipline-Thématique-1= chimie |
| − | |Domaine-Discipline-Thématique-2= | + | |Domaine-Discipline-Thématique-2= acides |
| − | |Domaine-Discipline-Thématique-3= | + | |Domaine-Discipline-Thématique-3= bases |
| − | |Domaine-Discipline-Thématique-4= | + | |Domaine-Discipline-Thématique-4= milieu neutre |
| − | |Domaine-Discipline-Thématique-5= | + | |Domaine-Discipline-Thématique-5= fruits |
| − | |Domaine-Discipline-Thématique-6= | + | |Domaine-Discipline-Thématique-6= légumes |
| − | |Domaine-Discipline-Thématique-7= | + | |Domaine-Discipline-Thématique-7= détergeant |
| − | |Domaine-Discipline-Thématique-8= | + | |Domaine-Discipline-Thématique-8= |
|Domaine-Discipline-Thématique-9= | |Domaine-Discipline-Thématique-9= | ||
|Domaine-Discipline-Thématique-10= | |Domaine-Discipline-Thématique-10= | ||
| Ligne 51 : | Ligne 51 : | ||
<!-- *************** Commercez les modifications *******************--> | <!-- *************** Commercez les modifications *******************--> | ||
| − | *....... | + | *Le pH est une grandeur sans unité. Un indice qui permet de mesurer l'activité de l'ion hydrogène dans une solution. L'eau pure contient la même quantité -- même si c'est en proportion très faible -- d'ions hydronium H3O+ et hydroxyde HO- . Elle est neutre. Car pour un milieu donné, le pH est fonction de la concentration en ions hydronium. Il est donné par la relation suivante : pH = -log [H3O+]. Un milieu acide contient donc plus d'ions hydronium que l'eau pure. Un milieu basique en revanche compte plus d'ions hydroxydes que l'eau pure. |
| − | + | *L'abréviation pH renvoie à la notion de potentiel hydrogène. Un concept introduit par le chimiste danois Soren Sorensen en 1893 alors qu'il étudiait la fabrication de la bière. Le pH est depuis devenu un indicateur de l'acidité -- lorsque le pH est inférieur à 7 -- ou de l'alcalinité -- lorsque le pH est supérieur à 7 -- d'une solution. Un milieu neutre affiche un pH égal à 7. C'est le cas de l'eau pure à 25 °C. | |
| − | |||
| − | |||
| − | *.... | ||
| − | |||
| − | |||
<!-- ******** Fin Définition Générale ***************************** --> | <!-- ******** Fin Définition Générale ***************************** --> | ||
Version du 3 décembre 2019 à 15:42
 Traduction
Traduction
 Définition
Définition
Domaine, Discipline, Thématique
Définition écrite
- Le pH est une grandeur sans unité. Un indice qui permet de mesurer l'activité de l'ion hydrogène dans une solution. L'eau pure contient la même quantité -- même si c'est en proportion très faible -- d'ions hydronium H3O+ et hydroxyde HO- . Elle est neutre. Car pour un milieu donné, le pH est fonction de la concentration en ions hydronium. Il est donné par la relation suivante : pH = -log [H3O+]. Un milieu acide contient donc plus d'ions hydronium que l'eau pure. Un milieu basique en revanche compte plus d'ions hydroxydes que l'eau pure.
- L'abréviation pH renvoie à la notion de potentiel hydrogène. Un concept introduit par le chimiste danois Soren Sorensen en 1893 alors qu'il étudiait la fabrication de la bière. Le pH est depuis devenu un indicateur de l'acidité -- lorsque le pH est inférieur à 7 -- ou de l'alcalinité -- lorsque le pH est supérieur à 7 -- d'une solution. Un milieu neutre affiche un pH égal à 7. C'est le cas de l'eau pure à 25 °C.
....................................................................... ....................................................................... .......................................................................
....................................................................... ....................................................................... |
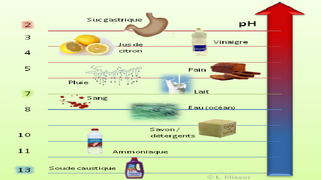
Définition graphique
 Concepts ou notions associés
Concepts ou notions associés
 Exemples, applications, utilisations
Exemples, applications, utilisations
................................................................................ ................................................................................ ................................................................................
................................................................................ ................................................................................ ................................................................................ |
 Erreurs ou confusions éventuelles
Erreurs ou confusions éventuelles
- Confusion entre ....... et ........
- Confusion entre ....... et ........
- Erreur fréquente: ....................
 Questions possibles
Questions possibles
 Liaisons enseignements et programmes
Liaisons enseignements et programmes
Idées ou Réflexions liées à son enseignement
Aides et astuces
Education: Autres liens, sites ou portails
 Bibliographie
Bibliographie
Pour citer cette page: (de pH)
ABROUGUI, M & al, 2019. Notion de pH. In Didaquest [en ligne]. <http:www.didaquest.org/wiki/Notion_de_pH>, consulté le 21, novembre, 2024
- ..................
- ..................
- ..................
- ..................