Différences entre versions de « La concentration molaire »
| Ligne 231 : | Ligne 231 : | ||
== <p style="color:#20B2AA; "> [[Fichier:Settings_Lot.png|40px]] Domaines d'applications: </p>== | == <p style="color:#20B2AA; "> [[Fichier:Settings_Lot.png|40px]] Domaines d'applications: </p>== | ||
| + | == <p style="color:#DC143C; "> [[Fichier:goal_Lot.png|25px]] 1. Domaine Agro-alimentaire </p>== | ||
| + | * Filtration stérilisante et clarification de boissons.. | ||
| + | * Élimination des bactéries du lait. | ||
| + | * Diminution de l’acidité de jus de fruit. | ||
Version du 6 février 2020 à 22:21
 Traduction
Traduction
[[Modèle:La masse molaire]] (Français)
/ the molar concetration (Anglais)
/ التركيز المولي (Arabe)
 Définition
Définition
Domaine, Discipline, Thématique
Définition écrite
![]() Définition de la concentration molaire
Définition de la concentration molaire
- La concentration molaire est une grandeur caractérisant toute solution, elle reflète la proportion d’une espèce chimique dissoute (soluté) par rapport à un solvant.
La concentration molaire (C) d’une espèce chimique est le rapport de la quantité (n) de cette espèce chimique par le volume (V) de la solution, ce qui se traduit par la formule suivante:
Latex formula
C est en général exprimé en mole par litre (mol/L), d’autres unités sont envisageable (mmol/L, mol/mL etc) mais la mol/L est l’unité la plus courante (la plupart des relations faisant intervenir la concentration molaire nécessitent cette unité).
n est mole (mol)
V est en litre (L)
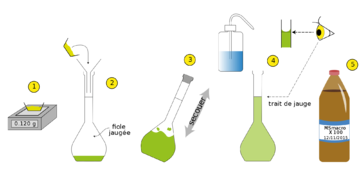
Sur une bouteille d'eau minérale, on trouve la donnée « calcium : 78 mg/litre ». Que signifie cette grandeur ? Considérons une eau de mer. A juste titre, on peut considérer qu'il s'agit d'une solution aqueuse (car le liquide majoritaire est l'eau) salée où les espèces dissoutes sont des ions (chlorure, sodium...). Il est facile de reproduire une telle solution homogène en prenant un certain volume d'eau dans lequel on dissout du sel : l'eau est le solvant et le sel, le soluté. Ainsi, une solution résulte de la dissolution d'un soluté dans un solvant. On peut compléter l'exemple précédent en constatant qu'un soluté peut être : * Solide : une solution aqueuse de glucose résulte de la dissolution du glucose (sucre) dans l'eau (des molécules de glucose sont en solution !) ; * Liquide : une solution d'éthanol résulte de la dissolution de molécules d'éthanol (alcool ordinaire) ; * Gazeux : une solution aqueuse d'acide chlorhydrique résulte de la dissolution du chlorure d'hydrogène. En solution, on y trouve des ions oxonium H3O+ et chlorure Cl-. Remarque : Si un soluté introduit dans un solvant n'est pas totalement dissous, on dira que la solution fabriquée est saturée. Expérience 1: Préparer une solution
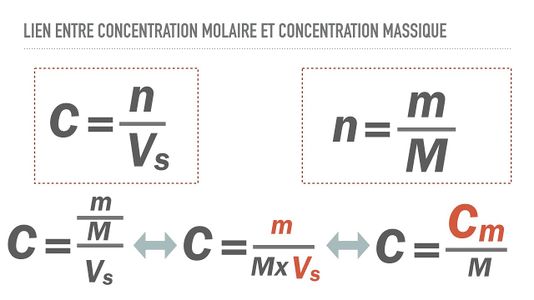
La concentration massique représente la quantité en masse de soluté dissoute dans un solvant pour obtenir un litre de solution. La concentration massique Cm est le quotient de la masse m dissoute et du volume V utilisé : Cm=m/v Formulation mathématique
Le % en masse
Chacune de ces concentrations reflète la proportion de soluté dissous dans une solution, la première se réfère à la quantité de matière et la deuxième à la masse. Il est possible de d’établir une relation entre les deux et d’exprimer l’une en fonction de le l’autre. Soit:
On peut également déduire la concentration massique à partir de la centration molaire grâce à la relation suivante:
|
Définition graphique
 Concepts ou notions associés
Concepts ou notions associés
 Exemples, applications, utilisations
Exemples, applications, utilisations
|
 Erreurs ou confusions éventuelles
Erreurs ou confusions éventuelles
- Confusion entre Masse volumique et Densité
- Confusion entre Poids et Masse
- Erreur fréquente: Le fer est toujours plus lourd que la laine
 Questions possibles
Questions possibles
- Si le pétrole flotte sur l’eau, c’est parce que: ... ?
- Parmi les matériaux et liquides suivants, lesquels flottent sur l’eau ?
- La formule qui relie la masse m, le volume V et la masse volumique ρ est ?
- Parmi les matériaux et liquides suivants, lesquels flottent sur l’eau ?
- La formule qui relie la masse m, le volume V et la masse volumique ρ est ?
 Liaisons enseignements et programmes
Liaisons enseignements et programmes
Idées ou Réflexions liées à son enseignement
Aides et astuces
Education: Autres liens, sites ou portails
 Bibliographie
Bibliographie
Pour citer cette page: (concentration molaire)
ABROUGUI, M & al, 2020. La concentration molaire. In Didaquest [en ligne]. <http:www.didaquest.org/wiki/La_concentration_molaire>, consulté le 11, mai, 2025
- ..................
- ..................
- ..................
- ..................