Différences entre versions de « Concentration »
| (46 versions intermédiaires par 2 utilisateurs non affichées) | |||
| Ligne 11 : | Ligne 11 : | ||
<!-- ****************** Commercez les modifications ************************--> | <!-- ****************** Commercez les modifications ************************--> | ||
| − | [[{{FULLPAGENAME}}]] (Français) | + | [[{{FULLPAGENAME}}]] (Français) |
| − | / [[concentration]] | + | / [[concentration]] (Anglais) |
/ [[تركيز] (Arabe) | / [[تركيز] (Arabe) | ||
| − | + | / [[concentración ]] (Espagnol) | |
| − | + | / [[Konzentration]] (Allemand) | |
| + | / [[concentrazione]] (Italien) | ||
| + | / [[浓度]] ( Chinois) | ||
| + | / [[концентрация]] (Russe) | ||
| + | / [[koncentration]] (Danois) | ||
| + | / [[konsantrasyon]] (Turc) | ||
| + | / [[koncentration]] (Suédois) | ||
| + | / [[soustředění]] (Tchèque) | ||
| + | / [[濃度]] (Japonais) | ||
| + | / [[συγκέντρωση]] (Grec) | ||
| + | / [[konsentrasi]] (Indonésien) | ||
| + | / [[concentração]] (Portugais) | ||
| + | / [[համակենտրոնացում]] (Arménien) | ||
= {{Widget:Definition-Fiche}} = | = {{Widget:Definition-Fiche}} = | ||
| Ligne 29 : | Ligne 41 : | ||
|Domaine-Discipline-Thématique-2= Chimie analytique | |Domaine-Discipline-Thématique-2= Chimie analytique | ||
|Domaine-Discipline-Thématique-3= Physique | |Domaine-Discipline-Thématique-3= Physique | ||
| − | |Domaine-Discipline-Thématique-4= | + | |Domaine-Discipline-Thématique-4=Biochimie |
| − | |Domaine-Discipline-Thématique-5= | + | |Domaine-Discipline-Thématique-5=Biologie |
| − | |Domaine-Discipline-Thématique-6= | + | |Domaine-Discipline-Thématique-6=Microbiologie |
| − | |Domaine-Discipline-Thématique-7= | + | |Domaine-Discipline-Thématique-7=Indudustrie |
| − | |Domaine-Discipline-Thématique-8= | + | |Domaine-Discipline-Thématique-8=Agriculture |
| − | |Domaine-Discipline-Thématique-9= | + | |Domaine-Discipline-Thématique-9=Génie des procédés |
| − | |Domaine-Discipline-Thématique-10= | + | |Domaine-Discipline-Thématique-10=Minérologie |
}}<!--****************** Fin modifications: Fiche-Disciplines-Thématiques *****************************--> | }}<!--****************** Fin modifications: Fiche-Disciplines-Thématiques *****************************--> | ||
| Ligne 48 : | Ligne 60 : | ||
|Définition= <!-- Ne pas Modifier --> | |Définition= <!-- Ne pas Modifier --> | ||
<!-- *************** Commercez les modifications *******************--> | <!-- *************** Commercez les modifications *******************--> | ||
| + | * De façon générale: La concentration d'une solution est la quantité de substance dissoute (le soluté) dans un volume donné de solvant. Elle s'exprime généralement en grammes par litre (g/l) pour les solutions liquides. | ||
| + | : Exemple : 1 litre d'eau dans lequel on mélange 10 g de sel | ||
| + | : → concentration = 10 g/l | ||
| + | : où la masse de soluté s'exprime en gramme (g) et le volume de solvant en litre (l) | ||
| − | *.. | + | * De façon plus spécifique: En chimie, la concentration possède deux significations: un procédé chimique ou une grandeur pourvue d’une unité. |
| − | . | + | La concentration est un procédé chimique qui consiste, soit à éliminer du solvant et augmenter la quantité de soluté par rapport au volume de solution. |
| − | . | + | La concentration est une grandeur permettant au chimiste de quantifier la composition d'une solution. |
| − | + | * La [[concentration molaire]] est le nombre de mole présentes par volume de solution. Elle est exprimée en grammes par litre (g/L). | |
| − | * | + | * La [[concentration massique]] ( ou [[concentration pondérale]]) est la masse d'un soluté présent dans un certain volume de solvant. Elle est exprimée en en mol/L. |
| − | + | * La concentration est la mesure de la quantité d'une matière donnée dissoute dans un volume d'une autre substance. | |
| − | . | + | * C'est la quantité de soluté dissoute dans un solvant. |
| + | * Pour concentrer une solution, il faut rajouter du soluté ou réduire la quantité de solvant | ||
| + | * Concentrer est l'opération inverse de diluer. Pour diluer une solution, il faut rajouter du solvant ou diminuer la quantité de soluté. | ||
<!-- ******** Fin Définition Générale ***************************** --> | <!-- ******** Fin Définition Générale ***************************** --> | ||
| Ligne 62 : | Ligne 80 : | ||
|Typologie= <!------------------------------------ Ne pas Modifier --> | |Typologie= <!------------------------------------ Ne pas Modifier --> | ||
<!-- ****************** Commercez les modifications ****************--> | <!-- ****************** Commercez les modifications ****************--> | ||
| − | + | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
}}<!-- ******** Fin Fiche Didactique Définition ******************* --> | }}<!-- ******** Fin Fiche Didactique Définition ******************* --> | ||
| Ligne 83 : | Ligne 95 : | ||
<!-- Remplacez, Adaptez, Ajoutez ou Supprimez les images et lignes non utilisées--> | <!-- Remplacez, Adaptez, Ajoutez ou Supprimez les images et lignes non utilisées--> | ||
| − | Image: | + | Image:images.takwa.jpeg|Solutions |
| − | Image: | + | Image:Image -tice -sol.jpeg|Formule |
| − | Image: | + | Image:solvant-soluté-tice.jpeg|Composition d'une solution |
| − | |||
</gallery><!-- ************** Fin modification images***************************--> | </gallery><!-- ************** Fin modification images***************************--> | ||
<!-- ************************* Début modification Vidéo ******************************************************************--> | <!-- ************************* Début modification Vidéo ******************************************************************--> | ||
|Video=<!-- Ne pas Modifier --><!-- Ajoutez une ou plusieurs vidéos--------------------------------------------------------> | |Video=<!-- Ne pas Modifier --><!-- Ajoutez une ou plusieurs vidéos--------------------------------------------------------> | ||
| − | <!-- Balises à utiliser Pour: Youtube : < | + | <!-- Balises à utiliser Pour: Youtube : <6nS9HUruiT0> / Google : <gvideo> / Archive.org audio : <aoaudio> / Archive.org video: <aovideo> |
/ WeGame : <wegame> / Tangler forum : <tangler> / Gametrailers: <gtrailer> / Nicovideo : <nicovideo> / GoGreenTube : <ggtube> -----> | / WeGame : <wegame> / Tangler forum : <tangler> / Gametrailers: <gtrailer> / Nicovideo : <nicovideo> / GoGreenTube : <ggtube> -----> | ||
<!-- <youtube>ID-Video</youtube> exemple http://www.youtube.com/watch?v=k0O8-0kPQmM devient <youtube>k0O8-0kPQmM</youtube> --> | <!-- <youtube>ID-Video</youtube> exemple http://www.youtube.com/watch?v=k0O8-0kPQmM devient <youtube>k0O8-0kPQmM</youtube> --> | ||
| Ligne 96 : | Ligne 107 : | ||
<!-- ****************** Commercez les modifications pour les Vidéos *******************************************************--> | <!-- ****************** Commercez les modifications pour les Vidéos *******************************************************--> | ||
| − | <youtube width="220" height="220"> | + | <youtube width="220" height="220">6nS9HUruiT0</youtube> |
| − | <youtube width="220" height="220"> | + | <youtube width="220" height="220">rmf7RzsquIg</youtube> |
| − | <youtube width="220" height="220"> | + | <youtube width="220" height="220">vVvGlQTKDos</youtube> |
| + | <youtube width="220" height="220">HgtoTSmcOHo</youtube> | ||
| + | |||
}}<!-- ************************* Fin modifications pour les Médias *******************************************************--> | }}<!-- ************************* Fin modifications pour les Médias *******************************************************--> | ||
| Ligne 111 : | Ligne 124 : | ||
<!----------------- Commencez les modifications des Mots Clés ---------------------> | <!----------------- Commencez les modifications des Mots Clés ---------------------> | ||
| − | |Mot-Clé-1= | + | |Mot-Clé-1=Solution |
| − | |Mot-Clé-2= | + | |Mot-Clé-2=Volume |
| − | |Mot-Clé-3= | + | |Mot-Clé-3=Masse |
| − | |Mot-Clé-4= | + | |Mot-Clé-4=Solvant |
| − | |Mot-Clé-5= | + | |Mot-Clé-5=Soluté |
| − | |Mot-Clé-6= | + | |Mot-Clé-6=Quantité de matière |
| − | |Mot-Clé-7= | + | |Mot-Clé-7=Rassemblement |
| − | |Mot-Clé-8= | + | |Mot-Clé-8=Dissolution |
| − | |Mot-Clé-9= | + | |Mot-Clé-9=Dilution |
| − | |Mot-Clé-10= | + | |Mot-Clé-10=Solubilité |
| − | + | |Mot-Clé-10=Solution homogène | |
}}<!-- ********************* FIN Fiche Didactique Mots-clés *******************--> | }}<!-- ********************* FIN Fiche Didactique Mots-clés *******************--> | ||
| − | |||
= {{Widget:Exemples-applications-utilisations-Fiche}} = | = {{Widget:Exemples-applications-utilisations-Fiche}} = | ||
| Ligne 135 : | Ligne 147 : | ||
<!-- ****************** Commercez les modifications *********************** --> | <!-- ****************** Commercez les modifications *********************** --> | ||
| − | * | + | *Dosage par étalonnage: un dosage est une technique qui permet de déterminer la concentration molaire |
| − | + | d'une espèce chimique dissoute dans une solution. | |
| − | + | *Pour concentrer une solution: réaliser une distillation fractionnée, il est possible d'augmenterle | |
| − | + | taux de concentration des solutés dans une solution. | |
| − | * | + | *Exemple: l'eau de mer est salée parceque des sels sont dissous dans l'eau; on peut augmenter le |
| − | + | taux de concentration en évaporant l'eau et ffinalement obtenir la matière souche contenue dans l'eau de mer ou sel marin. | |
| − | |||
| − | |||
}}<!--************** Fin Fiche Didactique Explicitations ******************* --> | }}<!--************** Fin Fiche Didactique Explicitations ******************* --> | ||
| − | |||
= {{Widget:Erreurs-confusions-Fiche}} = | = {{Widget:Erreurs-confusions-Fiche}} = | ||
| Ligne 156 : | Ligne 165 : | ||
<!-- ****************** Commercez les modifications *************************--> | <!-- ****************** Commercez les modifications *************************--> | ||
| − | * Confusion entre [[ | + | * Confusion entre [[Concentration et quantité de matière]] |
| − | * Confusion entre [[ | + | * Confusion entre [[Concentration molaire et concentration massique]] |
| − | * Erreur fréquente: | + | * Confusion entre [[Volume de solvant et volume de solution]] |
| + | * Confusion entre [[Concentration et dissolution]] | ||
| + | * Souvent, les élèves considèrent que la concentration est une mesure d'un écart entre particules, quand ilya plus d'écart, c'est moins concentré. | ||
| + | * La concentration n'est pas comprise comme une proportion. | ||
| + | * La concentration d'un mélange de deux solutions est égale à la somme des concentrations des deux solutions isolées. | ||
| + | * La concentration est assimilée à un rassemblement: les molécules ( ou les ions s'il s'agit d'un électrolyte) de soluté se rapprochent. | ||
| + | * Erreur fréquente: Concentration massique/Masse volumique | ||
}}<!-- ************** Fin Fiche Didactique Conceptions ********************* --> | }}<!-- ************** Fin Fiche Didactique Conceptions ********************* --> | ||
| − | |||
= {{Widget:Questions-possibles-Fiche}} = | = {{Widget:Questions-possibles-Fiche}} = | ||
| Ligne 171 : | Ligne 185 : | ||
<!-- Compléter les pointillés et Supprimer les lignes non utilisées--> | <!-- Compléter les pointillés et Supprimer les lignes non utilisées--> | ||
<!-- ************ Commercez les modifications *********************--> | <!-- ************ Commercez les modifications *********************--> | ||
| + | * [[Qu'est-ce que la concentration chimique ?]] | ||
| + | * [[Comment mesurer la concentration d'une solution ?]] | ||
| + | * [[Comment diminuer la concentration d'une solution ?]] | ||
| + | * [[Qu'est-ce que la dilution?]] | ||
| + | * [[Quelle est l'unité de la Concentration molaire ?]] | ||
| + | * [[Quand on mélange deux volumes différents de deux solutions identiques, est-ce que les concentrations des substances dissoutes changent?]] | ||
| + | * [[Comment calculer la concentration d'une solution ?]] | ||
| + | * [[Est-ce qu'on peut mesurer la concentration d'une solution hétérogène?]] | ||
| + | * [[Qu'est-ce qu'une solution homogène?]] | ||
| + | * [[Quelle est la relation entre la densité et la concentration ?]] | ||
| + | * [[Quelle est l'expression de la concentration ?]] | ||
| + | * [[Que représente V dans l'expression de la concentration ?]] | ||
| + | * [[Est-ce que la concentration est une grandeur intensive ou extensive ?]] | ||
| + | * [[Qu'est-ce qu'une grandeur intensive ?]] | ||
| + | * [[Qu'est-ce qu'une grandeur extensive ?]] | ||
| + | * [[Quelle est la relation entre la concentration molaire et la concentration massique ?]] | ||
| + | * [[Quelle est la relation entre la concentration massique et la masse volumique ?]] | ||
| − | |||
| − | |||
| − | |||
}}<!-- ******** Fin Fiche Didactique Questions ******************* --> | }}<!-- ******** Fin Fiche Didactique Questions ******************* --> | ||
| − | |||
= {{Widget:Liens-enseignement-Fiche}} = | = {{Widget:Liens-enseignement-Fiche}} = | ||
| Ligne 223 : | Ligne 250 : | ||
<!-- ****************** Commercez les modifications ************--> | <!-- ****************** Commercez les modifications ************--> | ||
| − | :* ... | + | :* https://www.superprof.fr/ressources/physique-chimie/seconde/solutions-acqueuses/concentration-massique.html |
| − | :* ... | + | :* https://www.superprof.fr/ressources/physique-chimie/seconde/solutions-acqueuses/concentration-mole.html |
| − | :* .... | + | :* https://www.lachimie.net/index.php?page=33#.XEiVJlVKjIU |
}}<!-- ************ Fin Liens Education ********************** --> | }}<!-- ************ Fin Liens Education ********************** --> | ||
Version actuelle datée du 9 février 2020 à 10:18
 Traduction
Traduction
{{Fiche Didactique Traduction |Concepts Traduits=
Concentration (Français) / concentration (Anglais) / [[تركيز] (Arabe) / concentración (Espagnol) / Konzentration (Allemand) / concentrazione (Italien) / 浓度 ( Chinois) / концентрация (Russe) / koncentration (Danois) / konsantrasyon (Turc) / koncentration (Suédois) / soustředění (Tchèque) / 濃度 (Japonais) / συγκέντρωση (Grec) / konsentrasi (Indonésien) / concentração (Portugais) / համակենտրոնացում (Arménien)
 Définition
Définition
Domaine, Discipline, Thématique
Définition écrite
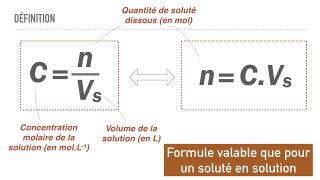
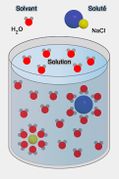
- De façon générale: La concentration d'une solution est la quantité de substance dissoute (le soluté) dans un volume donné de solvant. Elle s'exprime généralement en grammes par litre (g/l) pour les solutions liquides.
- Exemple : 1 litre d'eau dans lequel on mélange 10 g de sel
- → concentration = 10 g/l
- où la masse de soluté s'exprime en gramme (g) et le volume de solvant en litre (l)
- De façon plus spécifique: En chimie, la concentration possède deux significations: un procédé chimique ou une grandeur pourvue d’une unité.
La concentration est un procédé chimique qui consiste, soit à éliminer du solvant et augmenter la quantité de soluté par rapport au volume de solution. La concentration est une grandeur permettant au chimiste de quantifier la composition d'une solution.
- La concentration molaire est le nombre de mole présentes par volume de solution. Elle est exprimée en grammes par litre (g/L).
- La concentration massique ( ou concentration pondérale) est la masse d'un soluté présent dans un certain volume de solvant. Elle est exprimée en en mol/L.
- La concentration est la mesure de la quantité d'une matière donnée dissoute dans un volume d'une autre substance.
- C'est la quantité de soluté dissoute dans un solvant.
- Pour concentrer une solution, il faut rajouter du soluté ou réduire la quantité de solvant
- Concentrer est l'opération inverse de diluer. Pour diluer une solution, il faut rajouter du solvant ou diminuer la quantité de soluté.
Définition graphique
 Concepts ou notions associés
Concepts ou notions associés
Solution / Volume / Masse / Solvant / Soluté / Quantité de matière / Rassemblement / Dissolution / Dilution / Solution homogène /
 Exemples, applications, utilisations
Exemples, applications, utilisations
d'une espèce chimique dissoute dans une solution.
taux de concentration des solutés dans une solution.
taux de concentration en évaporant l'eau et ffinalement obtenir la matière souche contenue dans l'eau de mer ou sel marin. |
 Erreurs ou confusions éventuelles
Erreurs ou confusions éventuelles
- Confusion entre Concentration et quantité de matière
- Confusion entre Concentration molaire et concentration massique
- Confusion entre Volume de solvant et volume de solution
- Confusion entre Concentration et dissolution
- Souvent, les élèves considèrent que la concentration est une mesure d'un écart entre particules, quand ilya plus d'écart, c'est moins concentré.
- La concentration n'est pas comprise comme une proportion.
- La concentration d'un mélange de deux solutions est égale à la somme des concentrations des deux solutions isolées.
- La concentration est assimilée à un rassemblement: les molécules ( ou les ions s'il s'agit d'un électrolyte) de soluté se rapprochent.
- Erreur fréquente: Concentration massique/Masse volumique
 Questions possibles
Questions possibles
- Qu'est-ce que la concentration chimique ?
- Comment mesurer la concentration d'une solution ?
- Comment diminuer la concentration d'une solution ?
- Qu'est-ce que la dilution?
- Quelle est l'unité de la Concentration molaire ?
- Quand on mélange deux volumes différents de deux solutions identiques, est-ce que les concentrations des substances dissoutes changent?
- Comment calculer la concentration d'une solution ?
- Est-ce qu'on peut mesurer la concentration d'une solution hétérogène?
- Qu'est-ce qu'une solution homogène?
- Quelle est la relation entre la densité et la concentration ?
- Quelle est l'expression de la concentration ?
- Que représente V dans l'expression de la concentration ?
- Est-ce que la concentration est une grandeur intensive ou extensive ?
- Qu'est-ce qu'une grandeur intensive ?
- Qu'est-ce qu'une grandeur extensive ?
- Quelle est la relation entre la concentration molaire et la concentration massique ?
- Quelle est la relation entre la concentration massique et la masse volumique ?
 Liaisons enseignements et programmes
Liaisons enseignements et programmes
Idées ou Réflexions liées à son enseignement
Aides et astuces
Education: Autres liens, sites ou portails
 Bibliographie
Bibliographie
Pour citer cette page: ([1])
ABROUGUI, M & al, 2020. Concentration. In Didaquest [en ligne]. <http:www.didaquest.org/wiki/Concentration>, consulté le 21, novembre, 2024
- ..................
- ..................
- ..................
- ..................
- Pages utilisant des arguments dupliqués dans les appels de modèle
- Sponsors Education
- Chimie générale (Concepts)
- Chimie analytique (Concepts)
- Physique (Concepts)
- Biochimie (Concepts)
- Biologie (Concepts)
- Microbiologie (Concepts)
- Indudustrie (Concepts)
- Agriculture (Concepts)
- Génie des procédés (Concepts)
- Minérologie (Concepts)
- Solution
- Volume
- Masse
- Solvant
- Soluté
- Quantité de matière
- Rassemblement
- Dissolution
- Dilution
- Solution homogène
- Concepts
- Concentration
- Concentration (Concepts)
- Fiche conceptuelle didactique