Différences entre versions de « Liaisons chimiques »
| (31 versions intermédiaires par 2 utilisateurs non affichées) | |||
| Ligne 29 : | Ligne 29 : | ||
|Domaine-Discipline-Thématique-2= Physique | |Domaine-Discipline-Thématique-2= Physique | ||
|Domaine-Discipline-Thématique-3= Sciences de Matériaux | |Domaine-Discipline-Thématique-3= Sciences de Matériaux | ||
| − | |Domaine-Discipline-Thématique-4= | + | |Domaine-Discipline-Thématique-4= Biologie |
| − | |Domaine-Discipline-Thématique-5= | + | |Domaine-Discipline-Thématique-5= Biochimie |
|Domaine-Discipline-Thématique-6= | |Domaine-Discipline-Thématique-6= | ||
|Domaine-Discipline-Thématique-7= | |Domaine-Discipline-Thématique-7= | ||
| Ligne 49 : | Ligne 49 : | ||
<!-- *************** Commercez les modifications *******************--> | <!-- *************** Commercez les modifications *******************--> | ||
| − | *Une liaison chimique est une interaction durable entre plusieurs atomes, ions ou molécules, à une distance permettant la stabilisation du système et la formation d'un agrégat ou d'une substance chimique | + | * Une liaison chimique est une interaction durable entre plusieurs [[atomes]], [[ions]] ou [[molécules]], à une distance permettant la stabilisation du système et la formation d'un agrégat ou d'une substance chimique |
| − | |||
| − | |||
| − | |||
<!-- ******** Fin Définition Générale ***************************** --> | <!-- ******** Fin Définition Générale ***************************** --> | ||
| Ligne 59 : | Ligne 56 : | ||
|Typologie= <!------------------------------------ Ne pas Modifier --> | |Typologie= <!------------------------------------ Ne pas Modifier --> | ||
<!-- ****************** Commercez les modifications ****************--> | <!-- ****************** Commercez les modifications ****************--> | ||
| − | *... | + | {{@}} '''Exemples de liaisons chimiques''': |
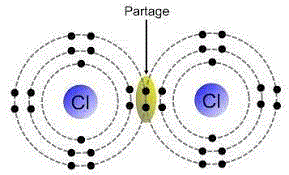
| − | .... | + | * La '''[[liaison covalente]]''' est l'interaction entre les atomes d'une molécule. Cette liaison peut être non polarisée, si les atomes ont pratiquement la même [[électronégativité]], ou polarisée si la différence entre leurs électronégativités reste inférieure à 1,7 (valeur conventionnelle). Au-delà de cette valeur, l'interaction est dite ionique. Une liaison covalente (polarisée ou non) peut être simple, double ou triple. |
| − | + | * Une '''[[liaison ionique]]''' (ou [[liaison électrovalente]]) est un type de liaison chimique qui peut être formé par une paire d'atomes possédant une grande différence d'électronégativité (par convention, supérieure à 1,7) typiquement entre un non-métal et un métal. Le métal donne un ou plusieurs électrons pour former un ion chargé positivement (cation). Le non-métal capte ces électrons pour former un ion chargé négativement (anion). Les deux ions formés possèdent fréquemment une configuration électronique de gaz rare (ils respectent la règle de l'octet ou la règle du duet). La liaison résulte de l'attraction entre le cation dérivant du métal et l'anion dérivant du non-métal. | |
| − | + | * Une '''[[liaison métallique]]''' est une liaison chimique résultant de l'action d'un fluide d'électrons délocalisés unissant des atomes ionisés positivement. Les matériaux métalliques purs ou alliés sont caractérisés par un continuum de niveaux d'énergie entre la bande de valence, occupée par les électrons de valence, et la bande de conduction, occupée par les électrons libres, de sorte que ces derniers sont injectés thermiquement depuis la bande de valence par-delà le niveau de Fermi, assurant la formation d'une liaison métallique délocalisée dans tout le volume du métal. | |
| − | *. | + | |
| − | |||
| − | |||
}}<!-- ******** Fin Fiche Didactique Définition ******************* --> | }}<!-- ******** Fin Fiche Didactique Définition ******************* --> | ||
| Ligne 80 : | Ligne 75 : | ||
<!-- Remplacez, Adaptez, Ajoutez ou Supprimez les images et lignes non utilisées--> | <!-- Remplacez, Adaptez, Ajoutez ou Supprimez les images et lignes non utilisées--> | ||
| − | Image: | + | Image:liaion_ionique.gif|liaison ionique |
| − | Image: | + | Image:liaison_covalente.gif|liaison covalente |
| − | Image: | + | Image:liaison_métalique.gif|liaison métallique |
</gallery><!-- ************** Fin modification images***************************--> | </gallery><!-- ************** Fin modification images***************************--> | ||
| Ligne 102 : | Ligne 97 : | ||
<!-- ****************** Commercez les modifications pour les autres médias*******************************************************--> | <!-- ****************** Commercez les modifications pour les autres médias*******************************************************--> | ||
* '''AUTRES MEDIAS''' | * '''AUTRES MEDIAS''' | ||
| − | {{Gg}} [https://www.google.com/search?q= | + | {{Gg}} [https://www.google.com/search?q=liaison_chimiques {{PAGENAME}}] |
{{Commons}} [https://commons.wikimedia.org/w/index.php?search={{PAGENAME}} {{PAGENAME}}] | {{Commons}} [https://commons.wikimedia.org/w/index.php?search={{PAGENAME}} {{PAGENAME}}] | ||
{{cc}} Représentation graphique spatiale [https://cmapscloud.ihmc.us:443/rid=1ZRGKQL01-1TF8794-R67QZS {{PAGENAME}}]''' | {{cc}} Représentation graphique spatiale [https://cmapscloud.ihmc.us:443/rid=1ZRGKQL01-1TF8794-R67QZS {{PAGENAME}}]''' | ||
| Ligne 116 : | Ligne 111 : | ||
<!----------------- Commencez les modifications des Mots Clés ---------------------> | <!----------------- Commencez les modifications des Mots Clés ---------------------> | ||
| − | |Mot-Clé-1= | + | |Mot-Clé-1= Liaison covalent |
| − | |Mot-Clé-2= | + | |Mot-Clé-2= Liaison ionique |
| − | |Mot-Clé-3= | + | |Mot-Clé-3= Liaison métallique |
| − | |Mot-Clé-4= | + | |Mot-Clé-4= Liaison hydrogène |
| − | |Mot-Clé-5= | + | |Mot-Clé-5= Polarité des Liaisons |
| − | |Mot-Clé-6= | + | |Mot-Clé-6= Électronégativité |
| − | |Mot-Clé-7= | + | |Mot-Clé-7= Orbitales Moléculaires |
| − | |Mot-Clé-8= | + | |Mot-Clé-8= Règle de l'Octet |
| − | |Mot-Clé-9= | + | |Mot-Clé-9= Énergie de Liaison |
| − | |Mot-Clé-10= | + | |Mot-Clé-10= Longueur et Angle de Liaison |
| − | |Mot-Clé-11= | + | |Mot-Clé-11= Résonance |
| − | |Mot-Clé-12= | + | |Mot-Clé-12= Hybridation des Orbitales |
| − | |Mot-Clé-13= | + | |Mot-Clé-13= Forces de Van der Waals |
| − | |Mot-Clé-14= | + | |Mot-Clé-14= Liaison Sigma et Pi |
| − | |Mot-Clé-15= | + | |Mot-Clé-15= Théorie de la Répulsion des Paires d'Électrons de la Couche de Valence (VSEPR) |
| − | |Mot-Clé-16= | + | |Mot-Clé-16= Théorie des Orbitales Moléculaires |
| + | |Mot-Clé-17= Liaison Coordonnée ou Dative | ||
| + | |Mot-Clé-18= Stabilité des Composés | ||
| + | |Mot-Clé-19= Composés Coordonnés | ||
| + | |Mot-Clé-20=Règles de Lewis. | ||
}}<!-- ********************* FIN Fiche Didactique Mots-clés *******************--> | }}<!-- ********************* FIN Fiche Didactique Mots-clés *******************--> | ||
| Ligne 166 : | Ligne 165 : | ||
{{@}} '''Erreur: Croire que''' | {{@}} '''Erreur: Croire que''' | ||
| − | * ........ | + | |
| − | * . | + | Dans l'enseignement des liaisons chimiques, comme dans tout domaine scientifique, il existe certaines idées fausses ou erreurs de compréhension courantes parmi les étudiants. Voici quelques exemples typiques : |
| + | *'''Confusion entre liaisons covalentes et ioniques''' : Les étudiants peuvent avoir du mal à distinguer entre ces deux types de liaisons, en particulier dans le cas de liaisons polaires et non polaires. | ||
| + | *'''Simplification excessive de la règle de l'octet''' : La règle de l'octet est une généralisation utile, mais elle ne s'applique pas à tous les éléments ou dans toutes les situations. Certains étudiants peuvent mal interpréter cette règle comme étant universelle. | ||
| + | *'''Méconnaissance de la nature des orbitales moléculaires''' : La représentation des orbitales comme des zones simples où les électrons résident peut conduire à une compréhension incomplète de leur nature probabiliste et de leur complexité. | ||
| + | *'''Sous-estimation de l'importance des forces intermoléculaires''' : Les étudiants peuvent négliger le rôle des forces de Van der Waals, des liaisons hydrogène et d'autres interactions intermoléculaires, qui sont cruciales pour comprendre les propriétés des substances. | ||
| + | *'''Manque de compréhension des propriétés des ions et des molécules''' : Certains peuvent avoir du mal à lier les types de liaisons chimiques aux propriétés physiques et chimiques des substances, comme la solubilité, le point de fusion, ou la conductivité. | ||
| + | *'''Confusion entre la liaison chimique et la réaction chimique''' : Il est important de distinguer clairement entre la formation d'une liaison (un processus statique) et une réaction chimique (un processus dynamique). | ||
| + | *'''Erreurs dans la représentation de Lewis''' : Les diagrammes de Lewis sont un outil clé en chimie, mais leur utilisation incorrecte peut entraîner des erreurs dans la compréhension de la structure des molécules. | ||
| + | *'''Sur-généralisation des tendances périodiques''' : Bien que les tendances périodiques soient utiles pour prédire le comportement chimique, elles ont des exceptions et ne doivent pas être appliquées de manière trop rigide. | ||
| + | *'''Méconnaissance de la liaison métallique''' : Les étudiants peuvent ne pas bien comprendre la nature unique de la liaison métallique, en particulier son caractère délocalisé. | ||
| + | |||
| + | Pour corriger ces erreurs, il est important de fournir des explications claires, des exemples concrets, et de mettre en place des activités pédagogiques qui encouragent une compréhension profonde et nuancée des liaisons chimiques. | ||
{{@}} '''Confusion possible ou glissement de sens''' | {{@}} '''Confusion possible ou glissement de sens''' | ||
| − | * Confusion entre [[ | + | |
| − | * Confusion entre [[ | + | Dans l'enseignement et l'apprentissage des liaisons chimiques, il est courant de rencontrer des confusions ou des glissements de sens. Voici quelques exemples de phrases qui illustrent ces types de confusion : |
| − | * Confusion entre [[ | + | |
| − | * Confusion entre [[ | + | * Confusion entre [[la liaison covalente - la liaison ionique ]] |
| − | * Confusion entre [[ | + | * Confusion entre [[ les forces intermoléculaires - les liaisons chimiques]] |
| − | * Confusion entre [[ | + | * Confusion entre [[ la polarité des molécules - la polarité des liaisons]] |
| − | * Confusion entre [[ | + | * Confusion entre [[les orbitales moléculaires - les orbitales atomiques]] |
| + | * Confusion entre [[la règle de l'octet - la stabilité des éléments ]] | ||
| + | * Confusion entre [[la réactivité chimique - la force de la liaison ]] | ||
| + | * Confusion entre [[la longueur - la liaison et sa force ]] | ||
| + | * Confusion entre [[les modèles - liaisons et la réalité]] | ||
| + | |||
| + | Ces confusions soulignent l'importance d'une pédagogie claire et nuancée dans l'enseignement de la chimie, en s'assurant que les étudiants comprennent non seulement les concepts, mais aussi leurs limites et contextes d'application. | ||
| + | |||
{{@}} '''Erreur fréquente''': | {{@}} '''Erreur fréquente''': | ||
* .................... | * .................... | ||
| Ligne 191 : | Ligne 208 : | ||
<!-- ************ Commercez les modifications *********************--> | <!-- ************ Commercez les modifications *********************--> | ||
| − | * [[ | + | * [[Quelle est la différence entre une liaison covalente et une liaison ionique ]]? |
| − | * [[ | + | * [[Comment la polarité d'une liaison chimique est-elle déterminée]]? |
| − | * [[ | + | * [[Qu'est-ce que la règle de l'octet et comment s'applique-t-elle aux liaisons chimiques]]? |
| + | * [[Quels sont les facteurs qui influencent la force d'une liaison chimique ]]? | ||
| + | * [[Comment l'électronégativité affecte-t-elle les liaisons chimiques]]? | ||
| + | * [[Qu'est-ce que la théorie des orbitales moléculaires et comment explique-t-elle la formation des liaisons]]? | ||
| + | * [[Comment la longueur et l'angle des liaisons affectent-ils la structure et les propriétés des molécules ]]? | ||
| + | * [[Quels sont les exemples d'applications pratiques de la compréhension des liaisons chimiques dans la science et la technologie ]]? | ||
| + | * [[Comment la résonance influence-t-elle la stabilité et la structure des molécules ]]? | ||
| + | * [[Qu'est-ce que l'hybridation des orbitales et comment cela affecte-t-il la géométrie des molécules]]? | ||
| + | * [[Comment les liaisons chimiques sont-elles représentées dans les structures de Lewis ]]? | ||
| + | * [[Quels sont les types et les caractéristiques des forces intermoléculaires]]? | ||
| + | * [[Comment les liaisons sigma et pi diffèrent-elles dans leur formation et leurs propriétés]]? | ||
| + | |||
| + | Ces questions couvrent une gamme de sujets fondamentaux en chimie et peuvent aider à approfondir la compréhension des liaisons chimiques et de leur importance dans divers domaines scientifiques. | ||
}}<!-- ******** Fin Fiche Didactique Questions ******************* --> | }}<!-- ******** Fin Fiche Didactique Questions ******************* --> | ||
| Ligne 209 : | Ligne 238 : | ||
<!-- ****************** Commercez les modifications ************************** --> | <!-- ****************** Commercez les modifications ************************** --> | ||
| − | * ....... | + | L'enseignement des liaisons chimiques, un sujet complexe et fondamental en chimie, offre de nombreuses opportunités pour des approches pédagogiques innovantes et engageantes. Voici quelques idées et réflexions pour l'enseignement de ce sujet : |
| − | :* | + | * '''Utilisation de Modèles Moléculaires''' : Les modèles en 3D aident les étudiants à visualiser la structure des molécules et à comprendre la spatialité des liaisons chimiques. |
| − | * . | + | :* '''Approches Basées sur des Projets''' : Encourager les étudiants à mener des projets de recherche sur des composés spécifiques pour explorer comment les liaisons chimiques influencent les propriétés et les usages de ces composés. |
| − | :* . | + | * '''Expériences de Laboratoire''' : Des expériences pratiques peuvent démontrer les effets des liaisons chimiques sur les propriétés physiques et chimiques, telles que la conductivité, la solubilité ou le point de fusion. |
| − | + | :* '''Utilisation de la Technologie''' : Des logiciels de modélisation moléculaire ou des applications de réalité augmentée peuvent rendre l'apprentissage des liaisons chimiques plus interactif et visuel. | |
| + | *'''Jeux et Activités Ludiques''' : Les jeux éducatifs et les activités de groupe peuvent rendre l'apprentissage des liaisons chimiques plus engageant et aider à mémoriser des concepts complexes. | ||
| + | :*'''Discussions sur des Applications Réelles''' : Relier les concepts de liaisons chimiques à des applications dans la vie quotidienne, comme les médicaments, les matériaux polymères, ou l'impact environnemental. | ||
| + | *'''Enseignement Interdisciplinaire''' : Intégrer des aspects de physique, de biologie et même de mathématiques pour montrer comment les liaisons chimiques jouent un rôle dans divers domaines. | ||
| + | :*'''Travail Collaboratif''' : Encourager les travaux de groupe pour favoriser l'échange d'idées et le développement de compétences en communication scientifique. | ||
| + | *'''Évaluation Formative''' : Utiliser des quiz et des tests réguliers pour évaluer la compréhension des étudiants et adapter les méthodes d'enseignement en conséquence. | ||
| + | :* '''Approfondissement Théorique''' : Fournir des ressources supplémentaires pour les étudiants avancés intéressés par des aspects plus complexes des liaisons chimiques, comme la théorie orbitale moléculaire ou la chimie quantique | ||
| + | L'objectif est de créer un environnement d'apprentissage où les étudiants peuvent explorer, expérimenter et comprendre de manière approfondie les concepts de liaisons chimiques, tout en développant des compétences en résolution de problèmes et en pensée critique. | ||
}}<!-- ************************* Fin Idées-Enseignement ********************** --> | }}<!-- ************************* Fin Idées-Enseignement ********************** --> | ||
| − | |||
== {{Widget:Aides et astuces-Fiche}} == | == {{Widget:Aides et astuces-Fiche}} == | ||
| Ligne 226 : | Ligne 261 : | ||
<!-- ****************** Commercez les modifications ************************** --> | <!-- ****************** Commercez les modifications ************************** --> | ||
| − | * ....... | + | Enseigner les liaisons chimiques peut être un défi, mais voici quelques aides et astuces pour rendre l'apprentissage plus accessible et intéressant pour les étudiants : |
| − | :* . | + | * '''Visualisation et Modélisation''' : Utiliser des modèles moléculaires, des logiciels de visualisation ou des animations pour aider les étudiants à comprendre la structure tridimensionnelle des molécules et la nature des liaisons. |
| − | * . | + | :*'''Analogies et Métaphores''' : Employez des analogies pour expliquer des concepts complexes. Par exemple, comparer les liaisons ioniques à une relation de "donner et prendre" peut aider les élèves à saisir l'idée du transfert d'électrons. |
| − | :* . | + | * '''Feuilles de Triche ou Cartes Conceptuelles''' : Créer des feuilles de triche ou des cartes conceptuelles qui résument les types de liaisons, leurs propriétés, et des exemples, pour une révision rapide et efficace. |
| + | :* '''Expériences de Laboratoire Simples''' : Concevoir des expériences simples pour montrer comment les liaisons chimiques influencent les propriétés physiques et chimiques, comme la conductivité ou la solubilité. | ||
| + | * '''Questions de Réflexion''' : Poser des questions ouvertes pour encourager les étudiants à réfléchir et à discuter des concepts de liaison chimique et de leur importance dans la vie réelle. | ||
| + | :* '''Groupes de Discussion''' : Organiser des groupes de discussion ou des séances de tutorat par les pairs pour permettre aux étudiants de s'expliquer mutuellement les concepts, ce qui renforce leur compréhension. | ||
| + | *'''Intégrer des Exemples Quotidiens''' : Relier les concepts à des exemples du quotidien pour montrer l'application pratique des liaisons chimiques, comme dans les produits ménagers, les médicaments, ou les matériaux. | ||
| + | :*'''Tests Formatifs Réguliers''' : Utiliser des quiz courts et réguliers pour évaluer la compréhension et identifier les domaines nécessitant plus d'attention. | ||
| + | * '''Encourager la Curiosité''' : Stimuler la curiosité des étudiants en présentant des aspects fascinants de la chimie, comme les réactions chimiques spectaculaires ou les matériaux innovants. | ||
| + | :*'''Fournir des Ressources Supplémentaires''' : Offrir des ressources supplémentaires, comme des vidéos éducatives, des articles, ou des sites web pour ceux qui souhaitent approfondir leur compréhension | ||
| + | |||
| + | En adoptant une approche variée et interactive, vous pouvez aider les étudiants à mieux comprendre et apprécier la complexité et la beauté des liaisons chimiques. | ||
| + | |||
}}<!-- ************************* Fin Astuces-Enseignement ********************** --> | }}<!-- ************************* Fin Astuces-Enseignement ********************** --> | ||
| Ligne 241 : | Ligne 286 : | ||
<!-- ****************** Commercez les modifications ************--> | <!-- ****************** Commercez les modifications ************--> | ||
| − | :* .......... | + | '''Sites Éducatifs et Portails en Ligne''' |
| − | : | + | *'''Coursera''': Offre des cours en ligne de chimie de diverses universités et institutions, souvent avec des modules dédiés aux liaisons chimiques. |
| − | : | + | *'''EdX''': Propose des cours en ligne gratuits ou certifiants en chimie, incluant des cours sur les liaisons chimiques, de diverses universités renommées. |
| + | *'''ChemCollective''': Site web financé par la National Science Foundation offrant des simulations, des tutoriels et des exercices virtuels sur de nombreux sujets de chimie. | ||
| + | *'''MIT OpenCourseWare''': Propose des supports de cours gratuits du Massachusetts Institute of Technology, y compris pour la chimie. | ||
| + | *'''ChemTube3D''': Offre des animations en 3D pour visualiser des structures moléculaires et comprendre les liaisons chimiques. | ||
| + | |||
| + | '''Ressources pour Enseignants et Éducateurs''' | ||
| + | *'''ACS (American Chemical Society) Education''': Fournit des ressources pédagogiques, des idées de leçons et des activités en laboratoire pour enseigner la chimie. | ||
| + | *'''Royal Society of Chemistry – Éducation''': Propose une multitude de ressources, d'activités et d'expériences pour l'enseignement de la chimie. | ||
| + | *'''TeacherTube''': Un site similaire à YouTube, mais dédié aux enseignants, offrant des vidéos éducatives sur la chimie et d'autres sujets. | ||
| + | |||
| + | '''Ressources pour Étudiants''' | ||
| + | *'''ChemGuide''': Un site conçu pour aider les étudiants de niveau secondaire et universitaire à comprendre les concepts de chimie. | ||
| + | *'''Khan Academy''': En plus de leurs cours vidéo, ils offrent également des exercices pratiques et un tableau de bord personnalisé pour suivre les progrès en chimie. | ||
| + | *'''PhET Interactive Simulations''' de l'Université du Colorado Boulder: Propose des simulations interactives gratuites en sciences, y compris en chimie. | ||
| + | |||
| + | '''Forums et Communautés''' | ||
| + | *'''Stack Exchange Chemistry''': Un forum où étudiants et professionnels peuvent poser des questions et partager des connaissances sur la chimie. | ||
| + | *'''Reddit – r/chemistry''': Une communauté active où les gens discutent des nouvelles, des questions et des curiosités liées à la chimie. | ||
| + | *'''Chemical Forums''': Un forum dédié à la discussion sur la chimie pour les étudiants et les professionnels. | ||
}}<!-- ************ Fin Liens Education ********************** --> | }}<!-- ************ Fin Liens Education ********************** --> | ||
= {{Widget:Bibliographie-Fiche}} = | = {{Widget:Bibliographie-Fiche}} = | ||
| − | |||
<!-- ************** Début Fiche Didactique Astuces-Enseignement *********--> | <!-- ************** Début Fiche Didactique Astuces-Enseignement *********--> | ||
| Ligne 257 : | Ligne 319 : | ||
<!-- ****************** Commercez les modifications *********************--> | <!-- ****************** Commercez les modifications *********************--> | ||
| − | * ............ | + | '''Manuels Fondamentaux''' |
| − | * .. | + | * "'''Chimie générale'''" par Ralph H. Petrucci, F. Geoffrey Herring, Jeffry D. Madura, et Carey Bissonnette. Un manuel complet qui couvre les principes fondamentaux de la chimie, y compris les liaisons chimiques. |
| − | * .. | + | * "'''Chimie: la science centrale'''" par Theodore L. Brown, H. Eugene LeMay, Bruce E. Bursten, et Catherine Murphy. Un ouvrage de référence qui offre une introduction approfondie à la chimie. |
| − | * .. | + | * "'''Principes de chimie'''" par Peter Atkins et Loretta Jones. Un livre reconnu pour son approche claire et structurée, qui explique bien les liaisons chimiques. |
| + | |||
| + | '''Ouvrages Spécialisés''' | ||
| + | * "'''Chimie Organique'''" par Paula Yurkanis Bruice. Ce livre se concentre sur la chimie organique et donne un aperçu détaillé des liaisons covalentes dans les molécules organiques. | ||
| + | * "'''Molecular Quantum Mechanic'''s" par Peter Atkins et Ronald Friedman. Pour une compréhension plus profonde des fondements théoriques des liaisons chimiques. | ||
| + | * "'''Inorganic Chemistry'''" par Duward Shriver et Peter Atkins. Utile pour explorer les liaisons chimiques dans les composés inorganiques. | ||
| + | '''Ressources Complémentaires''' | ||
| + | *"'''Chemistry: A Molecular Approac'''h" par Nivaldo J. Tro. Ce livre est apprécié pour sa capacité à rendre la chimie accessible et intéressante pour les débutants. | ||
| + | *"'''The Chemical Bond: Fundamental Aspects of Chemical Bondin'''g" édité par Gernot Frenking et Sason Shaik. Ce livre offre des perspectives approfondies sur la théorie et l'application des liaisons chimiques. | ||
| + | *"'''Valence Bond Theory'''" de David Cooper. Un excellent ouvrage pour ceux qui souhaitent approfondir leur compréhension de la théorie des liaison | ||
}}<!-- ************* Fin Fiche Didactique Bibliographie *************** --> | }}<!-- ************* Fin Fiche Didactique Bibliographie *************** --> | ||
{{Widget:Fiche-Conceptuelle-Bas}} | {{Widget:Fiche-Conceptuelle-Bas}} | ||
Version actuelle datée du 26 janvier 2024 à 13:41
 Traduction
Traduction
 Définition
Définition
Domaine, Discipline, Thématique
Définition écrite
|
|
Définition graphique
- AUTRES MEDIAS
![]() Liaisons chimiques
Liaisons chimiques
![]() chimiques Liaisons chimiques
chimiques Liaisons chimiques
![]() Représentation graphique spatiale Liaisons chimiques
Représentation graphique spatiale Liaisons chimiques
 Concepts ou notions associés
Concepts ou notions associés
Liaison covalent / Liaison ionique / Liaison métallique / Liaison hydrogène / Polarité des Liaisons / Électronégativité / Orbitales Moléculaires / Règle de l'Octet / Énergie de Liaison / Longueur et Angle de Liaison / Résonance / Hybridation des Orbitales / Forces de Van der Waals / Liaison Sigma et Pi / Théorie de la Répulsion des Paires d'Électrons de la Couche de Valence (VSEPR) / Théorie des Orbitales Moléculaires / Liaison Coordonnée ou Dative / Stabilité des Composés / Composés Coordonnés / Règles de Lewis. /
 Exemples, applications, utilisations
Exemples, applications, utilisations
................................................................................ ................................................................................ ................................................................................
................................................................................ ................................................................................ ................................................................................ |
 Erreurs ou confusions éventuelles
Erreurs ou confusions éventuelles
Dans l'enseignement des liaisons chimiques, comme dans tout domaine scientifique, il existe certaines idées fausses ou erreurs de compréhension courantes parmi les étudiants. Voici quelques exemples typiques :
- Confusion entre liaisons covalentes et ioniques : Les étudiants peuvent avoir du mal à distinguer entre ces deux types de liaisons, en particulier dans le cas de liaisons polaires et non polaires.
- Simplification excessive de la règle de l'octet : La règle de l'octet est une généralisation utile, mais elle ne s'applique pas à tous les éléments ou dans toutes les situations. Certains étudiants peuvent mal interpréter cette règle comme étant universelle.
- Méconnaissance de la nature des orbitales moléculaires : La représentation des orbitales comme des zones simples où les électrons résident peut conduire à une compréhension incomplète de leur nature probabiliste et de leur complexité.
- Sous-estimation de l'importance des forces intermoléculaires : Les étudiants peuvent négliger le rôle des forces de Van der Waals, des liaisons hydrogène et d'autres interactions intermoléculaires, qui sont cruciales pour comprendre les propriétés des substances.
- Manque de compréhension des propriétés des ions et des molécules : Certains peuvent avoir du mal à lier les types de liaisons chimiques aux propriétés physiques et chimiques des substances, comme la solubilité, le point de fusion, ou la conductivité.
- Confusion entre la liaison chimique et la réaction chimique : Il est important de distinguer clairement entre la formation d'une liaison (un processus statique) et une réaction chimique (un processus dynamique).
- Erreurs dans la représentation de Lewis : Les diagrammes de Lewis sont un outil clé en chimie, mais leur utilisation incorrecte peut entraîner des erreurs dans la compréhension de la structure des molécules.
- Sur-généralisation des tendances périodiques : Bien que les tendances périodiques soient utiles pour prédire le comportement chimique, elles ont des exceptions et ne doivent pas être appliquées de manière trop rigide.
- Méconnaissance de la liaison métallique : Les étudiants peuvent ne pas bien comprendre la nature unique de la liaison métallique, en particulier son caractère délocalisé.
Pour corriger ces erreurs, il est important de fournir des explications claires, des exemples concrets, et de mettre en place des activités pédagogiques qui encouragent une compréhension profonde et nuancée des liaisons chimiques.
![]() Confusion possible ou glissement de sens
Confusion possible ou glissement de sens
Dans l'enseignement et l'apprentissage des liaisons chimiques, il est courant de rencontrer des confusions ou des glissements de sens. Voici quelques exemples de phrases qui illustrent ces types de confusion :
- Confusion entre la liaison covalente - la liaison ionique
- Confusion entre les forces intermoléculaires - les liaisons chimiques
- Confusion entre la polarité des molécules - la polarité des liaisons
- Confusion entre les orbitales moléculaires - les orbitales atomiques
- Confusion entre la règle de l'octet - la stabilité des éléments
- Confusion entre la réactivité chimique - la force de la liaison
- Confusion entre la longueur - la liaison et sa force
- Confusion entre les modèles - liaisons et la réalité
Ces confusions soulignent l'importance d'une pédagogie claire et nuancée dans l'enseignement de la chimie, en s'assurant que les étudiants comprennent non seulement les concepts, mais aussi leurs limites et contextes d'application.
- ....................
 Questions possibles
Questions possibles
- Quelle est la différence entre une liaison covalente et une liaison ionique ?
- Comment la polarité d'une liaison chimique est-elle déterminée?
- Qu'est-ce que la règle de l'octet et comment s'applique-t-elle aux liaisons chimiques?
- Quels sont les facteurs qui influencent la force d'une liaison chimique ?
- Comment l'électronégativité affecte-t-elle les liaisons chimiques?
- Qu'est-ce que la théorie des orbitales moléculaires et comment explique-t-elle la formation des liaisons?
- Comment la longueur et l'angle des liaisons affectent-ils la structure et les propriétés des molécules ?
- Quels sont les exemples d'applications pratiques de la compréhension des liaisons chimiques dans la science et la technologie ?
- Comment la résonance influence-t-elle la stabilité et la structure des molécules ?
- Qu'est-ce que l'hybridation des orbitales et comment cela affecte-t-il la géométrie des molécules?
- Comment les liaisons chimiques sont-elles représentées dans les structures de Lewis ?
- Quels sont les types et les caractéristiques des forces intermoléculaires?
- Comment les liaisons sigma et pi diffèrent-elles dans leur formation et leurs propriétés?
Ces questions couvrent une gamme de sujets fondamentaux en chimie et peuvent aider à approfondir la compréhension des liaisons chimiques et de leur importance dans divers domaines scientifiques.
 Liaisons enseignements et programmes
Liaisons enseignements et programmes
Idées ou Réflexions liées à son enseignement
L'enseignement des liaisons chimiques, un sujet complexe et fondamental en chimie, offre de nombreuses opportunités pour des approches pédagogiques innovantes et engageantes. Voici quelques idées et réflexions pour l'enseignement de ce sujet :
- Utilisation de Modèles Moléculaires : Les modèles en 3D aident les étudiants à visualiser la structure des molécules et à comprendre la spatialité des liaisons chimiques.
- Approches Basées sur des Projets : Encourager les étudiants à mener des projets de recherche sur des composés spécifiques pour explorer comment les liaisons chimiques influencent les propriétés et les usages de ces composés.
- Expériences de Laboratoire : Des expériences pratiques peuvent démontrer les effets des liaisons chimiques sur les propriétés physiques et chimiques, telles que la conductivité, la solubilité ou le point de fusion.
- Utilisation de la Technologie : Des logiciels de modélisation moléculaire ou des applications de réalité augmentée peuvent rendre l'apprentissage des liaisons chimiques plus interactif et visuel.
- Jeux et Activités Ludiques : Les jeux éducatifs et les activités de groupe peuvent rendre l'apprentissage des liaisons chimiques plus engageant et aider à mémoriser des concepts complexes.
- Discussions sur des Applications Réelles : Relier les concepts de liaisons chimiques à des applications dans la vie quotidienne, comme les médicaments, les matériaux polymères, ou l'impact environnemental.
- Enseignement Interdisciplinaire : Intégrer des aspects de physique, de biologie et même de mathématiques pour montrer comment les liaisons chimiques jouent un rôle dans divers domaines.
- Travail Collaboratif : Encourager les travaux de groupe pour favoriser l'échange d'idées et le développement de compétences en communication scientifique.
- Évaluation Formative : Utiliser des quiz et des tests réguliers pour évaluer la compréhension des étudiants et adapter les méthodes d'enseignement en conséquence.
- Approfondissement Théorique : Fournir des ressources supplémentaires pour les étudiants avancés intéressés par des aspects plus complexes des liaisons chimiques, comme la théorie orbitale moléculaire ou la chimie quantique
L'objectif est de créer un environnement d'apprentissage où les étudiants peuvent explorer, expérimenter et comprendre de manière approfondie les concepts de liaisons chimiques, tout en développant des compétences en résolution de problèmes et en pensée critique.
Aides et astuces
Enseigner les liaisons chimiques peut être un défi, mais voici quelques aides et astuces pour rendre l'apprentissage plus accessible et intéressant pour les étudiants :
- Visualisation et Modélisation : Utiliser des modèles moléculaires, des logiciels de visualisation ou des animations pour aider les étudiants à comprendre la structure tridimensionnelle des molécules et la nature des liaisons.
- Analogies et Métaphores : Employez des analogies pour expliquer des concepts complexes. Par exemple, comparer les liaisons ioniques à une relation de "donner et prendre" peut aider les élèves à saisir l'idée du transfert d'électrons.
- Feuilles de Triche ou Cartes Conceptuelles : Créer des feuilles de triche ou des cartes conceptuelles qui résument les types de liaisons, leurs propriétés, et des exemples, pour une révision rapide et efficace.
- Expériences de Laboratoire Simples : Concevoir des expériences simples pour montrer comment les liaisons chimiques influencent les propriétés physiques et chimiques, comme la conductivité ou la solubilité.
- Questions de Réflexion : Poser des questions ouvertes pour encourager les étudiants à réfléchir et à discuter des concepts de liaison chimique et de leur importance dans la vie réelle.
- Groupes de Discussion : Organiser des groupes de discussion ou des séances de tutorat par les pairs pour permettre aux étudiants de s'expliquer mutuellement les concepts, ce qui renforce leur compréhension.
- Intégrer des Exemples Quotidiens : Relier les concepts à des exemples du quotidien pour montrer l'application pratique des liaisons chimiques, comme dans les produits ménagers, les médicaments, ou les matériaux.
- Tests Formatifs Réguliers : Utiliser des quiz courts et réguliers pour évaluer la compréhension et identifier les domaines nécessitant plus d'attention.
- Encourager la Curiosité : Stimuler la curiosité des étudiants en présentant des aspects fascinants de la chimie, comme les réactions chimiques spectaculaires ou les matériaux innovants.
- Fournir des Ressources Supplémentaires : Offrir des ressources supplémentaires, comme des vidéos éducatives, des articles, ou des sites web pour ceux qui souhaitent approfondir leur compréhension
En adoptant une approche variée et interactive, vous pouvez aider les étudiants à mieux comprendre et apprécier la complexité et la beauté des liaisons chimiques.
Education: Autres liens, sites ou portails
Sites Éducatifs et Portails en Ligne
- Coursera: Offre des cours en ligne de chimie de diverses universités et institutions, souvent avec des modules dédiés aux liaisons chimiques.
- EdX: Propose des cours en ligne gratuits ou certifiants en chimie, incluant des cours sur les liaisons chimiques, de diverses universités renommées.
- ChemCollective: Site web financé par la National Science Foundation offrant des simulations, des tutoriels et des exercices virtuels sur de nombreux sujets de chimie.
- MIT OpenCourseWare: Propose des supports de cours gratuits du Massachusetts Institute of Technology, y compris pour la chimie.
- ChemTube3D: Offre des animations en 3D pour visualiser des structures moléculaires et comprendre les liaisons chimiques.
Ressources pour Enseignants et Éducateurs
- ACS (American Chemical Society) Education: Fournit des ressources pédagogiques, des idées de leçons et des activités en laboratoire pour enseigner la chimie.
- Royal Society of Chemistry – Éducation: Propose une multitude de ressources, d'activités et d'expériences pour l'enseignement de la chimie.
- TeacherTube: Un site similaire à YouTube, mais dédié aux enseignants, offrant des vidéos éducatives sur la chimie et d'autres sujets.
Ressources pour Étudiants
- ChemGuide: Un site conçu pour aider les étudiants de niveau secondaire et universitaire à comprendre les concepts de chimie.
- Khan Academy: En plus de leurs cours vidéo, ils offrent également des exercices pratiques et un tableau de bord personnalisé pour suivre les progrès en chimie.
- PhET Interactive Simulations de l'Université du Colorado Boulder: Propose des simulations interactives gratuites en sciences, y compris en chimie.
Forums et Communautés
- Stack Exchange Chemistry: Un forum où étudiants et professionnels peuvent poser des questions et partager des connaissances sur la chimie.
- Reddit – r/chemistry: Une communauté active où les gens discutent des nouvelles, des questions et des curiosités liées à la chimie.
- Chemical Forums: Un forum dédié à la discussion sur la chimie pour les étudiants et les professionnels.
 Bibliographie
Bibliographie
Pour citer cette page: (chimiques)
ABROUGUI, M & al, 2024. Liaisons chimiques. In Didaquest [en ligne]. <http:www.didaquest.org/wiki/Liaisons_chimiques>, consulté le 24, novembre, 2024
Manuels Fondamentaux
- "Chimie générale" par Ralph H. Petrucci, F. Geoffrey Herring, Jeffry D. Madura, et Carey Bissonnette. Un manuel complet qui couvre les principes fondamentaux de la chimie, y compris les liaisons chimiques.
- "Chimie: la science centrale" par Theodore L. Brown, H. Eugene LeMay, Bruce E. Bursten, et Catherine Murphy. Un ouvrage de référence qui offre une introduction approfondie à la chimie.
- "Principes de chimie" par Peter Atkins et Loretta Jones. Un livre reconnu pour son approche claire et structurée, qui explique bien les liaisons chimiques.
Ouvrages Spécialisés
- "Chimie Organique" par Paula Yurkanis Bruice. Ce livre se concentre sur la chimie organique et donne un aperçu détaillé des liaisons covalentes dans les molécules organiques.
- "Molecular Quantum Mechanics" par Peter Atkins et Ronald Friedman. Pour une compréhension plus profonde des fondements théoriques des liaisons chimiques.
- "Inorganic Chemistry" par Duward Shriver et Peter Atkins. Utile pour explorer les liaisons chimiques dans les composés inorganiques.
Ressources Complémentaires
- "Chemistry: A Molecular Approach" par Nivaldo J. Tro. Ce livre est apprécié pour sa capacité à rendre la chimie accessible et intéressante pour les débutants.
- "The Chemical Bond: Fundamental Aspects of Chemical Bonding" édité par Gernot Frenking et Sason Shaik. Ce livre offre des perspectives approfondies sur la théorie et l'application des liaisons chimiques.
- "Valence Bond Theory" de David Cooper. Un excellent ouvrage pour ceux qui souhaitent approfondir leur compréhension de la théorie des liaison
- Sponsors Education
- Chimie (Concepts)
- Physique (Concepts)
- Sciences de Matériaux (Concepts)
- Biologie (Concepts)
- Biochimie (Concepts)
- Liaison covalent
- Liaison ionique
- Liaison métallique
- Liaison hydrogène
- Polarité des Liaisons
- Électronégativité
- Orbitales Moléculaires
- Règle de l'Octet
- Énergie de Liaison
- Longueur et Angle de Liaison
- Résonance
- Hybridation des Orbitales
- Forces de Van der Waals
- Liaison Sigma et Pi
- Théorie de la Répulsion des Paires d'Électrons de la Couche de Valence (VSEPR)
- Théorie des Orbitales Moléculaires
- Liaison Coordonnée ou Dative
- Stabilité des Composés
- Composés Coordonnés
- Règles de Lewis.
- Concepts
- Liaisons chimiques
- Liaisons chimiques (Concepts)
- Fiche conceptuelle didactique