Différences entre versions de « Réaction d'oxydoréduction »
(Page créée avec « {{widget:HautFicheConceptuelle}} {{widget:PBEducation}}<!-- La syntaxe suivante ne doit pas être modifiée--> = {{Widget:Traduction-Fiche}} = Concept en Français (... ») |
|||
| (30 versions intermédiaires par le même utilisateur non affichées) | |||
| Ligne 4 : | Ligne 4 : | ||
= {{Widget:Traduction-Fiche}} = | = {{Widget:Traduction-Fiche}} = | ||
| − | [[ | + | [[Réaction d'oxydoréduction]] (Français) / [[Oxidation-reduction reaction]] (Anglais) / [[رد فعل الأكسدة]] (Arabe) |
| − | |||
= {{Widget:Definition-Fiche}} = | = {{Widget:Definition-Fiche}} = | ||
* '''Domaine, Discipline, Thématique''' : | * '''Domaine, Discipline, Thématique''' : | ||
| − | [[:Catégorie: | + | [[:Catégorie: Chimie ]] / [[:Catégorie: Biologie ]] / [[:Catégorie: Développement durable]] |
== {{Widget:Definition-ecrite-Fiche}} == | == {{Widget:Definition-ecrite-Fiche}} == | ||
| Ligne 17 : | Ligne 16 : | ||
<!-- Remplacer et adapter le contenu --> | <!-- Remplacer et adapter le contenu --> | ||
| − | + | ||
| − | . | + | Une réaction d’oxydoréduction est toute [[transformation chimique]] au cours de laquelle il y a transfert d’un (ou de plusieurs) électron(s) entre deux entités chimiques. Le transfert se fait du [[réducteur]] d’un premier [[couple redox]] vers l’[[oxydant]] d’un deuxième couple redox. |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
* Autre Définition : | * Autre Définition : | ||
| − | + | Une réaction d'oxydoréduction est une transformation chimique qui met en jeu une variation du [[nombre d'oxydation]] d'un atome d'un élément chimique. | |
{{Widget:Fin-cadre-Bleu}} | {{Widget:Fin-cadre-Bleu}} | ||
| − | |||
== {{Widget:Definition-graphique-Fiche}} == | == {{Widget:Definition-graphique-Fiche}} == | ||
| Ligne 37 : | Ligne 30 : | ||
<!-- Remplacer et adapter le contenu --> | <!-- Remplacer et adapter le contenu --> | ||
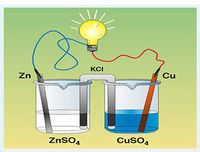
| − | [[Fichier: | + | [[Fichier:PileDaniell.jpg |200 px|Pile Daniell]]<!-- Remplacer et adapter le contenu --> |
| − | [[Fichier: | + | [[Fichier:Corroded-anchor.jpg |200 px|Corroded-anchor]]<!-- Remplacer et adapter le contenu --> |
| − | + | ||
{{Widget:Fin-cadre-Bleu}} | {{Widget:Fin-cadre-Bleu}} | ||
| Ligne 49 : | Ligne 42 : | ||
<!-- Remplacer et adapter le contenu --> | <!-- Remplacer et adapter le contenu --> | ||
| − | [[ | + | [[Transformation chimique]] / [[entité chimique]] / [[élément chimique]] / [[électron]] / [[oxydant]] / [[réducteur]] / [[atome]] / [[Nombre d'oxydation]] |
| Ligne 56 : | Ligne 49 : | ||
= {{Widget:Exemples-applications-utilisations-Fiche}} = | = {{Widget:Exemples-applications-utilisations-Fiche}} = | ||
| − | * | + | * Exemple |
| − | * | + | Fe + Cu^2+ ---> Fe^2+ + Cu |
| − | + | * La réaction d'oxydoréduction se manifeste : | |
| + | - dans les piles électrochimiques | ||
| + | - dans le phénomène de corrosion | ||
= {{Widget:Erreurs-confusions-Fiche}} = | = {{Widget:Erreurs-confusions-Fiche}} = | ||
| − | * . | + | * La réaction d'oxydoréduction met en jeu nécessairement l'élément oxygène. |
| − | * | + | * Le transfert d'électrons ne peut se faire qu'en milieu aqueux |
| + | * La réaction d’oxydoréduction doit mettre en jeu quatre entités chimiques, conjuguée deux à deux. | ||
= {{Widget:Questions-possibles-Fiche}} = | = {{Widget:Questions-possibles-Fiche}} = | ||
| − | * | + | * Ecrire l’équation d’une réaction d’oxydoréduction : |
| + | - connaissant les couples redox mis en jeu. | ||
| + | - Connaissant les résultats expérimentaux | ||
| + | * Identifier les couples redox dans une équation d’une réaction d’oxydoréduction | ||
| + | * Montrer qu'une équation chimique correspond à une réaction d'oxydoréduction | ||
= {{Widget:Liens-enseignement-Fiche}} = | = {{Widget:Liens-enseignement-Fiche}} = | ||
| Ligne 78 : | Ligne 78 : | ||
= {{Widget:Aides-astuces-Fiche}} = | = {{Widget:Aides-astuces-Fiche}} = | ||
| + | * Commencer par l’étude des réactions entre les métaux et les cations métalliques mettant en jeu des couples redox simples. | ||
| + | * Par la suite introduire des réactions mettant en jeu des couples redox complexes. | ||
= {{Widget:Difficultes-enseignement-Fiche}} = | = {{Widget:Difficultes-enseignement-Fiche}} = | ||
| + | Démonstration du transfert des électrons dans le cas des réactions par voie sèche. | ||
= {{Widget:Liens-internet-Fiche}} = | = {{Widget:Liens-internet-Fiche}} = | ||
| − | * '''URL''' : | + | * '''URL''' :http://www.physagreg.fr/Cours1ere/Chimie/Cours/Chimie-chapitre6-oxydoreduction.pdf |
| − | * '''URL''' : | + | * '''URL''' :http://www.lachimie.net/index.php?page=47#.WHvQ49LhBdg |
| − | |||
= {{Widget:Bibliographie-Fiche}} = | = {{Widget:Bibliographie-Fiche}} = | ||
| Ligne 96 : | Ligne 98 : | ||
[[Category:Domaine ou Thématique ou Discipline]] | [[Category:Domaine ou Thématique ou Discipline]] | ||
[[Category: Fiches didactiques]] | [[Category: Fiches didactiques]] | ||
| + | |||
| + | [[Category:Superviseur Khiari Alaya Fathi]] | ||
| + | [[Category:Superviseur]] | ||
Version actuelle datée du 18 janvier 2017 à 21:58
 Traduction
Traduction
Réaction d'oxydoréduction (Français) / Oxidation-reduction reaction (Anglais) / رد فعل الأكسدة (Arabe)
 Définition
Définition
- Domaine, Discipline, Thématique :
Catégorie: Chimie / Catégorie: Biologie / Catégorie: Développement durable
Définition écrite
|
Une réaction d'oxydoréduction est une transformation chimique qui met en jeu une variation du nombre d'oxydation d'un atome d'un élément chimique. |
Définition graphique
 Concepts ou notions associés
Concepts ou notions associés
 Exemples, applications, utilisations
Exemples, applications, utilisations
- Exemple
Fe + Cu^2+ ---> Fe^2+ + Cu
- La réaction d'oxydoréduction se manifeste :
- dans les piles électrochimiques
- dans le phénomène de corrosion
 Erreurs ou confusions éventuelles
Erreurs ou confusions éventuelles
- La réaction d'oxydoréduction met en jeu nécessairement l'élément oxygène.
- Le transfert d'électrons ne peut se faire qu'en milieu aqueux
- La réaction d’oxydoréduction doit mettre en jeu quatre entités chimiques, conjuguée deux à deux.
 Questions possibles
Questions possibles
- Ecrire l’équation d’une réaction d’oxydoréduction :
- connaissant les couples redox mis en jeu. - Connaissant les résultats expérimentaux
- Identifier les couples redox dans une équation d’une réaction d’oxydoréduction
- Montrer qu'une équation chimique correspond à une réaction d'oxydoréduction
 Liaisons enseignements et programmes
Liaisons enseignements et programmes
- Portail Formation Gratuite
- Multisites Educatifs
- Sur DidaQuest
- Sur le Portail Didactique.info
- Sur le Portail Questions / Réponses
- Concept Sur Wikipedia
- Concept Sur Wikiwand
- Concept Sur Wikiversity
 Aides, Astuces,...
Aides, Astuces,...
- Commencer par l’étude des réactions entre les métaux et les cations métalliques mettant en jeu des couples redox simples.
- Par la suite introduire des réactions mettant en jeu des couples redox complexes.
=
 Difficultés liées à son enseignement =
Difficultés liées à son enseignement =
Démonstration du transfert des électrons dans le cas des réactions par voie sèche.
 Liens Internet
Liens Internet
- URL :http://www.physagreg.fr/Cours1ere/Chimie/Cours/Chimie-chapitre6-oxydoreduction.pdf
- URL :http://www.lachimie.net/index.php?page=47#.WHvQ49LhBdg