Différences entre versions de « Concenration massique »
De Didaquest
Aller à la navigationAller à la recherche| (Une version intermédiaire par le même utilisateur non affichée) | |||
| Ligne 46 : | Ligne 46 : | ||
= {{Widget:Exemples-applications-utilisations-Fiche}} = | = {{Widget:Exemples-applications-utilisations-Fiche}} = | ||
| − | * | + | * La notion de concentration molaire s'applique typiquement en chimie et biologie, aux constituants en solution, mais elle est également valable à l'état pur et dans les mélanges gazeux. |
| − | |||
| + | * Dans les solutions ioniques, il existe le plus souvent plusieurs espèces chimiques en équilibre. Par exemple, une solution d'un acide faible HA contient les espèces H+, A– et HA à cause de l'équilibre de dissociation HA ⇆ H+ + A–. La concentration (molaire) de la matière acide est alors | ||
| + | cHA = [A–] + [H+], c'est-à-dire la somme des concentrations de ses espèces chimiques dérivées. | ||
| + | Ceci s'applique aux réactions d'ionisation, de complexation, d'oxydoréduction, etc. | ||
| + | * Les concentrations sont très utilisées en chimie, notamment en analyse quantitative par volumétrie, cinétique chimique, et théorie des ions (théorie de Debye-Hückel). En thermodynamique, on leur préfère les fractions molaires ou les molalités qui ont l'avantage d'être indépendantes de la température et de la pression. | ||
| + | * En biochimie et biologie, les concentrations molaires sont aussi très utilisées, pour déduire les concentrations des produits de réaction, ou à l'inverse des réactants d'origine quand on dose les produits | ||
= {{Widget:Erreurs-confusions-Fiche}} = | = {{Widget:Erreurs-confusions-Fiche}} = | ||
Version actuelle datée du 12 janvier 2017 à 17:02
 Traduction
Traduction
Concentration massique (Français) / Mass concentration (Anglais) / التركيز الكتلي (Arabe)
 Définition
Définition
- Domaine, Discipline, Thématique :
Catégorie: Chimie
Définition écrite
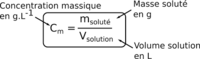
La concentration massique est une grandeur qui reflète la proportion de soluté dissout dans une solution aqueuse, elle se calcule en divisant la masse du soluté (m) par le volume de la solution (V) ce qui peut se traduire par la relation suivante : Cm= m/V avec m en (g), V en (L) et Cm en g.L-1 à ne pas confondre avec la concentration molaire.
|
Définition graphique
 Concepts ou notions associés
Concepts ou notions associés
 Exemples, applications, utilisations
Exemples, applications, utilisations
- La notion de concentration molaire s'applique typiquement en chimie et biologie, aux constituants en solution, mais elle est également valable à l'état pur et dans les mélanges gazeux.
- Dans les solutions ioniques, il existe le plus souvent plusieurs espèces chimiques en équilibre. Par exemple, une solution d'un acide faible HA contient les espèces H+, A– et HA à cause de l'équilibre de dissociation HA ⇆ H+ + A–. La concentration (molaire) de la matière acide est alors
cHA = [A–] + [H+], c'est-à-dire la somme des concentrations de ses espèces chimiques dérivées. Ceci s'applique aux réactions d'ionisation, de complexation, d'oxydoréduction, etc.
- Les concentrations sont très utilisées en chimie, notamment en analyse quantitative par volumétrie, cinétique chimique, et théorie des ions (théorie de Debye-Hückel). En thermodynamique, on leur préfère les fractions molaires ou les molalités qui ont l'avantage d'être indépendantes de la température et de la pression.
- En biochimie et biologie, les concentrations molaires sont aussi très utilisées, pour déduire les concentrations des produits de réaction, ou à l'inverse des réactants d'origine quand on dose les produits
 Erreurs ou confusions éventuelles
Erreurs ou confusions éventuelles
- Attention à ne pas confondre la concentration massique ,La concentration molaire et la concentration volumique
 Questions possibles
Questions possibles
- Question:
- Calculer la concentration massique C d’une solution en fonction de la masse m et le volume V.
- Mesurer la masse du soluté, le volume du solvant .
 Liaisons enseignements et programmes
Liaisons enseignements et programmes
- Portail Formation Gratuite
- Multisites Educatifs
- Sur DidaQuest
- Sur le Portail Didactique.info
- Sur le Portail Questions / Réponses
- Concept Sur Wikipedia
- Concept Sur Wikiwand
- Concept Sur Wikiversity
 Aides, Astuces,...
Aides, Astuces,...
- Dissoudre le sel de cuisine dans l’eau en mesurant la masse de sel et le volume d’eau
- Déterminer le solvant du soluté et le nom de la solution
- Calculer à chaque fois la concentration de la solution correspondante
- Déterminer l’ionisation de particules présentes dans la solution
- Ecrire l’équation de la réaction correspondante
=
 Difficultés liées à son enseignement =
Difficultés liées à son enseignement =
- Déterminer la masse en excès par les élèves
- Identifier les facteurs qui influent sur la concentration massique
 Liens Internet
Liens Internet
- URL : http://clausschimphycol.chez-alice.fr/Concentration5.html
- URL : http://www.physique-chimie-lycee.fr/cours-seconde-chimie/sa06_2-concentration-massique.html