Différences entre versions de « Pouvoir réducteur d'un métal »
| (6 versions intermédiaires par le même utilisateur non affichées) | |||
| Ligne 53 : | Ligne 53 : | ||
* Pile électrochimique | * Pile électrochimique | ||
* Métallurgie | * Métallurgie | ||
| − | + | * Corrosion | |
= {{Widget:Erreurs-confusions-Fiche}} = | = {{Widget:Erreurs-confusions-Fiche}} = | ||
* En présence de deux couples redox, on doit faire attention au pouvoir réducteur des réactifs mis en jeu pour juger le déroulement spontanée d'une telle réaction d'oxydoréduction | * En présence de deux couples redox, on doit faire attention au pouvoir réducteur des réactifs mis en jeu pour juger le déroulement spontanée d'une telle réaction d'oxydoréduction | ||
| − | * A ne pas confondre pile électrochimique et | + | * A ne pas confondre pile électrochimique et électrolyse |
= {{Widget:Questions-possibles-Fiche}} = | = {{Widget:Questions-possibles-Fiche}} = | ||
| − | * | + | * Comment peut-on prévoir le déroulement spontané d'une telle réaction d'oxydoréduction? |
| − | + | * En s'aidant de la classification électrochimique des métaux, indiquer s'il y a une réaction d’oxydoréduction | |
= {{Widget:Liens-enseignement-Fiche}} = | = {{Widget:Liens-enseignement-Fiche}} = | ||
| Ligne 72 : | Ligne 72 : | ||
= {{Widget:Aides-astuces-Fiche}} = | = {{Widget:Aides-astuces-Fiche}} = | ||
| + | * À l'aide de classification électrochimique des métaux, on pourra prédire si une réaction se fait spontanément ou si elle nécessite un apport d'énergie. Pour qu'une réaction spontanée d'oxydoréduction se produise entre deux métaux, il faut que le réducteur le plus fort soit à l'état solide et que le plus faible soit sous forme d'ions en milieu aqueux. | ||
| + | * On peut aussi vérifier la possibilité d'une réaction spontanée en additionnant les valeurs des potentiels de rédution Eº des deux demi-réactions impliquant les réactifs. | ||
| + | Si la valeur de l'énergie totale (Eº) est positive, la réaction sera alors spontanée. | ||
| + | Dans le cas contraire (≤ 0,00 V), la réaction ne sera pas possible, car c'est la réaction inverse qui sera favorisée. | ||
| + | La compréhension de la spontanéité d’une réaction est fondamentale en chimie, car elle est la base du fonctionnement des piles électrochimiques | ||
= {{Widget:Difficultes-enseignement-Fiche}} = | = {{Widget:Difficultes-enseignement-Fiche}} = | ||
| − | + | * Incapacité d'identifier les couples redox mis en jeu | |
| + | * Détermination de sens direct d'une réaction redox spontanée | ||
= {{Widget:Liens-internet-Fiche}} = | = {{Widget:Liens-internet-Fiche}} = | ||
| Ligne 91 : | Ligne 97 : | ||
[[Category:Domaine ou Thématique ou Discipline]] | [[Category:Domaine ou Thématique ou Discipline]] | ||
[[Category: Fiches didactiques]] | [[Category: Fiches didactiques]] | ||
| + | [[category: superviseur RTIMI ]] | ||
| + | [[category: superviseur ]] | ||
Version actuelle datée du 27 janvier 2017 à 12:45
 Traduction
Traduction
Pouvoir réducteur d'un métal (Français) / Reducer power of a metal (Anglais) / القدرة المخفضة عند المعدن (Arabe)
 Définition
Définition
- Domaine, Discipline, Thématique :
Catégorie: Chimie générale / Catégorie: Électrochimie / Catégorie: Métallurgie / Chimie des matériaux
Définition écrite
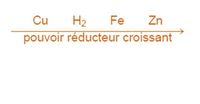
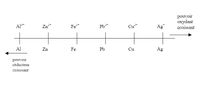
Le pouvoir réducteur d'un métal est sa tendance à vouloir donner ses électrons et à s'oxyder, il se compare généralement par rapport au dihydrogène. La tendance à donner des électrons varie d'un métal à l'autre, c'est pourquoi on parle d'échelle ou de classement de pouvoir réducteur. La présence du réducteur le plus fort permet à une réaction chimique de se dérouler spontanément.
Une réaction oxydoréduction spontanée survient lorsqu'elle peut s'effectuer naturellement, sans l'apport d'une forme d'énergie extérieure. |
Définition graphique
 Concepts ou notions associés
Concepts ou notions associés
 Exemples, applications, utilisations
Exemples, applications, utilisations
- Pile électrochimique
- Métallurgie
- Corrosion
 Erreurs ou confusions éventuelles
Erreurs ou confusions éventuelles
- En présence de deux couples redox, on doit faire attention au pouvoir réducteur des réactifs mis en jeu pour juger le déroulement spontanée d'une telle réaction d'oxydoréduction
- A ne pas confondre pile électrochimique et électrolyse
 Questions possibles
Questions possibles
- Comment peut-on prévoir le déroulement spontané d'une telle réaction d'oxydoréduction?
- En s'aidant de la classification électrochimique des métaux, indiquer s'il y a une réaction d’oxydoréduction
 Liaisons enseignements et programmes
Liaisons enseignements et programmes
- Portail Formation Gratuite
- Multisites Educatifs
- Sur DidaQuest
- Sur le Portail Didactique.info
- Sur le Portail Questions / Réponses
- Concept Sur Wikipedia
- Concept Sur Wikiwand
- Concept Sur Wikiversity
 Aides, Astuces,...
Aides, Astuces,...
- À l'aide de classification électrochimique des métaux, on pourra prédire si une réaction se fait spontanément ou si elle nécessite un apport d'énergie. Pour qu'une réaction spontanée d'oxydoréduction se produise entre deux métaux, il faut que le réducteur le plus fort soit à l'état solide et que le plus faible soit sous forme d'ions en milieu aqueux.
- On peut aussi vérifier la possibilité d'une réaction spontanée en additionnant les valeurs des potentiels de rédution Eº des deux demi-réactions impliquant les réactifs.
Si la valeur de l'énergie totale (Eº) est positive, la réaction sera alors spontanée. Dans le cas contraire (≤ 0,00 V), la réaction ne sera pas possible, car c'est la réaction inverse qui sera favorisée. La compréhension de la spontanéité d’une réaction est fondamentale en chimie, car elle est la base du fonctionnement des piles électrochimiques
=
 Difficultés liées à son enseignement =
Difficultés liées à son enseignement =
- Incapacité d'identifier les couples redox mis en jeu
- Détermination de sens direct d'une réaction redox spontanée
 Liens Internet
Liens Internet
- URL :
- URL :