Différences entre versions de « La demi-réaction d'oxydation »
(Page créée avec « {{widget:HautFicheConceptuelle}} {{widget:PBEducation}}<!-- La syntaxe suivante ne doit pas être modifiée--> = {{Widget:Traduction-Fiche}} = La demi-réaction d'oxyd... ») |
|||
| (7 versions intermédiaires par le même utilisateur non affichées) | |||
| Ligne 17 : | Ligne 17 : | ||
<!-- Remplacer et adapter le contenu --> | <!-- Remplacer et adapter le contenu --> | ||
| − | * | + | * Définition: |
| − | Lors d'une demi-réaction d'oxydation, une entité chimique perd un ou plusieurs de ces électrons. À chaque fois qu'elle donne n électron, sa charge , qui correspond à son degré d'oxydation, augmente de n. | + | Lors d'une demi-réaction d'oxydation, une entité chimique perd un ou plusieurs de ces électrons, elle mène à un oxydant. À chaque fois qu'elle donne n électron, sa charge , qui correspond à son degré d'oxydation, augmente de n. |
* Remarque : | * Remarque : | ||
Une demi-réaction d'oxydation ne se produit pas seule, elle est toujours accompagnée d'une demi-réaction de réduction. | Une demi-réaction d'oxydation ne se produit pas seule, elle est toujours accompagnée d'une demi-réaction de réduction. | ||
{{Widget:Fin-cadre-Bleu}} | {{Widget:Fin-cadre-Bleu}} | ||
| − | |||
== {{Widget:Definition-graphique-Fiche}} == | == {{Widget:Definition-graphique-Fiche}} == | ||
| Ligne 43 : | Ligne 42 : | ||
<!-- Remplacer et adapter le contenu --> | <!-- Remplacer et adapter le contenu --> | ||
| − | [[oxydant]] / [[Réaction d'oxydoréduction]] / [[ | + | [[oxydant]] / [[ Réducteur]] / [[Réaction d'oxydoréduction]] / [[Couple Redox]] / |
| Ligne 57 : | Ligne 56 : | ||
= {{Widget:Erreurs-confusions-Fiche}} = | = {{Widget:Erreurs-confusions-Fiche}} = | ||
| − | * | + | * A ne pas confondre la demi-réaction d'oxydation avec la demi réaction de réduction |
| − | * | + | * A ne pas confondre l'oxydant avec le réducteur |
= {{Widget:Questions-possibles-Fiche}} = | = {{Widget:Questions-possibles-Fiche}} = | ||
| − | * | + | * Comment peut-on distinguer la demi-réaction d'oxydation de la demi réaction de réduction? |
| − | + | * Comment peut-on différer un oxydant d'un réducteur? | |
= {{Widget:Liens-enseignement-Fiche}} = | = {{Widget:Liens-enseignement-Fiche}} = | ||
| Ligne 72 : | Ligne 71 : | ||
= {{Widget:Aides-astuces-Fiche}} = | = {{Widget:Aides-astuces-Fiche}} = | ||
| − | + | Dans l'équation de cette demi-réaction, les électrons font toujours partie des produits; ils sont donc situés à la droite de la flèche de l'équation. La substance qui donne un ou des électrons, en l’occurrence le réactif de la réaction, est nommée l'agent réducteur. Cette substance peut aussi être appelée substance oxydée. | |
= {{Widget:Difficultes-enseignement-Fiche}} = | = {{Widget:Difficultes-enseignement-Fiche}} = | ||
| − | + | * Il faut bien faire attention au place des électrons dans l'équation | |
| + | * Il faut tenir compte de la conservation de charge électrique dans l'équation | ||
= {{Widget:Liens-internet-Fiche}} = | = {{Widget:Liens-internet-Fiche}} = | ||
| Ligne 91 : | Ligne 91 : | ||
[[Category:Domaine ou Thématique ou Discipline]] | [[Category:Domaine ou Thématique ou Discipline]] | ||
[[Category: Fiches didactiques]] | [[Category: Fiches didactiques]] | ||
| + | [[category: superviseur RTIMI ]] | ||
| + | [[category: superviseur ]] | ||
Version actuelle datée du 27 janvier 2017 à 12:43
 Traduction
Traduction
La demi-réaction d'oxydation (Français) / The oxidation half-reaction (Anglais) / نصف تفاعل الأكسدة (Arabe)
 Définition
Définition
- Domaine, Discipline, Thématique :
Catégorie: Chimie générale / Catégorie: Électrochimie / Catégorie: Métallurgie
Définition écrite
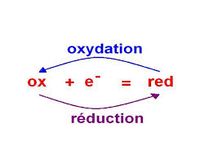
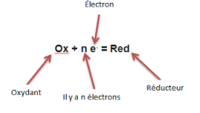
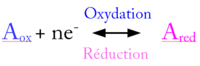
Lors d'une demi-réaction d'oxydation, une entité chimique perd un ou plusieurs de ces électrons, elle mène à un oxydant. À chaque fois qu'elle donne n électron, sa charge , qui correspond à son degré d'oxydation, augmente de n.
Une demi-réaction d'oxydation ne se produit pas seule, elle est toujours accompagnée d'une demi-réaction de réduction. |
Définition graphique
 Concepts ou notions associés
Concepts ou notions associés
 Exemples, applications, utilisations
Exemples, applications, utilisations
- Pile électrochimique
- Corrosion
 Erreurs ou confusions éventuelles
Erreurs ou confusions éventuelles
- A ne pas confondre la demi-réaction d'oxydation avec la demi réaction de réduction
- A ne pas confondre l'oxydant avec le réducteur
 Questions possibles
Questions possibles
- Comment peut-on distinguer la demi-réaction d'oxydation de la demi réaction de réduction?
- Comment peut-on différer un oxydant d'un réducteur?
 Liaisons enseignements et programmes
Liaisons enseignements et programmes
- Portail Formation Gratuite
- Multisites Educatifs
- Sur DidaQuest
- Sur le Portail Didactique.info
- Sur le Portail Questions / Réponses
- Concept Sur Wikipedia
- Concept Sur Wikiwand
- Concept Sur Wikiversity
 Aides, Astuces,...
Aides, Astuces,...
Dans l'équation de cette demi-réaction, les électrons font toujours partie des produits; ils sont donc situés à la droite de la flèche de l'équation. La substance qui donne un ou des électrons, en l’occurrence le réactif de la réaction, est nommée l'agent réducteur. Cette substance peut aussi être appelée substance oxydée.
=
 Difficultés liées à son enseignement =
Difficultés liées à son enseignement =
- Il faut bien faire attention au place des électrons dans l'équation
- Il faut tenir compte de la conservation de charge électrique dans l'équation
 Liens Internet
Liens Internet
- URL :
- URL :