Différences entre versions de « La demi-réaction de réduction »
| (Une version intermédiaire par le même utilisateur non affichée) | |||
| Ligne 61 : | Ligne 61 : | ||
* A ne pas confondre un oxydant avec un réducteur | * A ne pas confondre un oxydant avec un réducteur | ||
= {{Widget:Questions-possibles-Fiche}} = | = {{Widget:Questions-possibles-Fiche}} = | ||
| − | |||
| − | |||
* Comment peut-on distinguer la demi-réaction d'oxydation de la demi réaction de réduction? | * Comment peut-on distinguer la demi-réaction d'oxydation de la demi réaction de réduction? | ||
* Comment peut-on différer un oxydant d'un réducteur? | * Comment peut-on différer un oxydant d'un réducteur? | ||
| Ligne 93 : | Ligne 91 : | ||
[[Category:Domaine ou Thématique ou Discipline]] | [[Category:Domaine ou Thématique ou Discipline]] | ||
[[Category: Fiches didactiques]] | [[Category: Fiches didactiques]] | ||
| + | [[category: superviseur RTIMI ]] | ||
| + | [[category: superviseur ]] | ||
Version actuelle datée du 27 janvier 2017 à 12:44
 Traduction
Traduction
La demi-réaction de réduction (Français) / Reduction half-reaction (Anglais) / نصف تفاعل التخفيض (Arabe)
 Définition
Définition
- Domaine, Discipline, Thématique :
Catégorie: Chimie générale / Catégorie: Électrochimie / Catégorie: Métallurgie
Définition écrite
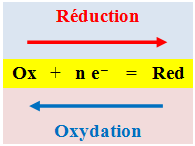
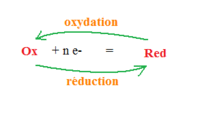
Lors d'une demi-réaction de réduction, une entité chimique gagne un ou plusieurs électrons, elle mène à un réducteur. À chaque fois qu'une entité chimique gagne ou accepte n électrons, son degré d'oxydation diminue de n.
Une demi-réaction de réduction ne peut se produire seule, elle est accompagnée d'une demi-réaction d'oxydation.
|
Définition graphique
 Concepts ou notions associés
Concepts ou notions associés
 Exemples, applications, utilisations
Exemples, applications, utilisations
- Pile électrochimique
- Corrosion
 Erreurs ou confusions éventuelles
Erreurs ou confusions éventuelles
- A ne pas confondre la demi-réaction de réduction avec celle d'oxydation
- A ne pas confondre un oxydant avec un réducteur
 Questions possibles
Questions possibles
- Comment peut-on distinguer la demi-réaction d'oxydation de la demi réaction de réduction?
- Comment peut-on différer un oxydant d'un réducteur?
 Liaisons enseignements et programmes
Liaisons enseignements et programmes
- Portail Formation Gratuite
- Multisites Educatifs
- Sur DidaQuest
- Sur le Portail Didactique.info
- Sur le Portail Questions / Réponses
- Concept Sur Wikipedia
- Concept Sur Wikiwand
- Concept Sur Wikiversity
 Aides, Astuces,...
Aides, Astuces,...
Dans l'équation de cette demi-réaction, les électrons font toujours partis des réactifs; ils sont donc situés à la gauche de la flèche de l'équation. La substance qui accepte des électrons, en l'occurence le réactifs de la réaction, est nommée l'agent oxydant. Cette substance peut aussi être appelée substance réduite.
=
 Difficultés liées à son enseignement =
Difficultés liées à son enseignement =
- Il faut bien faire attention au place des électrons dans l'équation
- Il faut tenir compte de la conservation de charge électrique dans l'équation
 Liens Internet
Liens Internet
- URL :
- URL :