Différences entre versions de « Avancement d'une réaction »
De Didaquest
Aller à la navigationAller à la recherche| (31 versions intermédiaires par le même utilisateur non affichées) | |||
| Ligne 11 : | Ligne 11 : | ||
<!-- ****************** Commercez les modifications ************************--> | <!-- ****************** Commercez les modifications ************************--> | ||
| − | + | Avancement d'une réaction (Français) | |
| − | / | + | / Progress of a chemical reaction (Anglais) |
| − | / | + | / تقدم التفاعل الكيميائي (Arabe) |
}}<!-- ************** Fin Fiche Didactique Traduction ********************* --> | }}<!-- ************** Fin Fiche Didactique Traduction ********************* --> | ||
| Ligne 26 : | Ligne 26 : | ||
<!--****************** Commercez les modifications: Fiche-Disciplines-Thématiques *********************--> | <!--****************** Commercez les modifications: Fiche-Disciplines-Thématiques *********************--> | ||
| − | |Domaine-Discipline-Thématique-1= | + | |Domaine-Discipline-Thématique-1= Physique |
|Domaine-Discipline-Thématique-2= Chimie | |Domaine-Discipline-Thématique-2= Chimie | ||
| − | |Domaine-Discipline-Thématique-3= | + | |Domaine-Discipline-Thématique-3= Cinétique chimique |
| − | |Domaine-Discipline-Thématique-4= | + | |Domaine-Discipline-Thématique-4= |
|Domaine-Discipline-Thématique-5= | |Domaine-Discipline-Thématique-5= | ||
|Domaine-Discipline-Thématique-6= | |Domaine-Discipline-Thématique-6= | ||
| Ligne 49 : | Ligne 49 : | ||
<!-- *************** Commercez les modifications *******************--> | <!-- *************** Commercez les modifications *******************--> | ||
| − | *L'avancement d'une réaction est une grandeur notée x qui s'exprime en mole. Il | + | *L'avancement d'une réaction est une grandeur notée x qui s'exprime en mole. Il caractérise l'évolution d'une réaction chimique entre son état initial et son état final |
| − | * | + | *A l'état initial l'avancement d'une réaction chimique est 0. |
| − | + | A l'état final la valeur de l'avancement est x<f> | |
| − | |||
<!-- ******** Fin Définition Générale ***************************** --> | <!-- ******** Fin Définition Générale ***************************** --> | ||
| Ligne 60 : | Ligne 59 : | ||
<!-- ****************** Commercez les modifications ****************--> | <!-- ****************** Commercez les modifications ****************--> | ||
*Par conséquent il s'agit aussi de la quantité de réactif qui disparaitrait avec un coefficient stoechiométrique de 1 | *Par conséquent il s'agit aussi de la quantité de réactif qui disparaitrait avec un coefficient stoechiométrique de 1 | ||
| − | + | ||
| − | |||
| − | |||
}}<!-- ******** Fin Fiche Didactique Définition ******************* --> | }}<!-- ******** Fin Fiche Didactique Définition ******************* --> | ||
| Ligne 77 : | Ligne 74 : | ||
<!-- Remplacez, Adaptez, Ajoutez ou Supprimez les images et lignes non utilisées--> | <!-- Remplacez, Adaptez, Ajoutez ou Supprimez les images et lignes non utilisées--> | ||
| − | Image: | + | Image:avancement MH1.jpg|avancement MH1 |
| − | Image: | + | Image:avancement MH4.jpg|avancement MH4 |
| − | + | ||
</gallery><!-- ************** Fin modification images***************************--> | </gallery><!-- ************** Fin modification images***************************--> | ||
| Ligne 93 : | Ligne 90 : | ||
<youtube width="220" height="220">=p7qxJk7z2cU&t=84s</youtube> | <youtube width="220" height="220">=p7qxJk7z2cU&t=84s</youtube> | ||
<youtube width="220" height="220">k0O8-0kPQmM</youtube> | <youtube width="220" height="220">k0O8-0kPQmM</youtube> | ||
| − | + | ||
| − | |||
}}<!-- ************************* Fin modifications pour les Médias *******************************************************--> | }}<!-- ************************* Fin modifications pour les Médias *******************************************************--> | ||
| Ligne 107 : | Ligne 103 : | ||
<!----------------- Commencez les modifications des Mots Clés ---------------------> | <!----------------- Commencez les modifications des Mots Clés ---------------------> | ||
| − | |Mot-Clé-1= | + | |Mot-Clé-1= Réaction chimique |
| − | |Mot-Clé-2= | + | |Mot-Clé-2= Réactif |
| − | |Mot-Clé-3= | + | |Mot-Clé-3= Produit |
| − | |Mot-Clé-4= | + | |Mot-Clé-4= Avancement d'une réaction |
| − | |Mot-Clé-5= | + | |Mot-Clé-5= réaction lente |
| − | |Mot-Clé-6= | + | |Mot-Clé-6= réaction rapide |
| − | |Mot-Clé-7= | + | |Mot-Clé-7= vitesse d'une réaction |
| − | |Mot-Clé-8= | + | |Mot-Clé-8= équilibre chimique |
|Mot-Clé-9= | |Mot-Clé-9= | ||
|Mot-Clé-10= | |Mot-Clé-10= | ||
}}<!-- ********************* FIN Fiche Didactique Mots-clés *******************--> | }}<!-- ********************* FIN Fiche Didactique Mots-clés *******************--> | ||
| − | |||
= {{Widget:Exemples-applications-utilisations-Fiche}} = | = {{Widget:Exemples-applications-utilisations-Fiche}} = | ||
| Ligne 131 : | Ligne 126 : | ||
<!-- ****************** Commercez les modifications *********************** --> | <!-- ****************** Commercez les modifications *********************** --> | ||
| − | * | + | *x=nombre de mole de réactif réagit/coefficient stoechiomètrique=nombre de mole de produit formé/coefficient stoechiomètrique |
| − | + | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
}}<!--************** Fin Fiche Didactique Explicitations ******************* --> | }}<!--************** Fin Fiche Didactique Explicitations ******************* --> | ||
| − | |||
= {{Widget:Erreurs-confusions-Fiche}} = | = {{Widget:Erreurs-confusions-Fiche}} = | ||
| Ligne 151 : | Ligne 139 : | ||
<!-- Compléter les pointillés et Supprimer les lignes non utilisées------------> | <!-- Compléter les pointillés et Supprimer les lignes non utilisées------------> | ||
<!-- ****************** Commercez les modifications *************************--> | <!-- ****************** Commercez les modifications *************************--> | ||
| − | |||
{{@}} '''Erreur: Croire que''' | {{@}} '''Erreur: Croire que''' | ||
| − | * | + | * Un changement d'état physique est une réaction chimique |
| − | + | {{@}} '''Confusion possible ou glissement de sens''' | |
| − | + | * Confusion entre équation - réaction | |
| − | {{@}} '''Confusion possible ou glissement de sens''' | + | * Confusion entre réactif - produit |
| − | * Confusion entre | ||
| − | * Confusion entre | ||
| − | |||
{{@}} '''Erreur fréquente''': | {{@}} '''Erreur fréquente''': | ||
| − | * | + | * Avancement final est égal à l'avancement maximal |
}}<!-- ************** Fin Fiche Didactique Conceptions ********************* --> | }}<!-- ************** Fin Fiche Didactique Conceptions ********************* --> | ||
| Ligne 174 : | Ligne 158 : | ||
<!-- ************ Commercez les modifications *********************--> | <!-- ************ Commercez les modifications *********************--> | ||
| − | * | + | * Une réaction est elle toujours totale ? |
| − | * | + | * C'est quoi une réaction partielle ? |
| − | + | }}<!-- ******** Fin Fiche Didactique Questions ******************* --> | |
| − | |||
| − | }}<!-- ******** Fin Fiche Didactique Questions ******************* --> | ||
= {{Widget:Liens-enseignement-Fiche}} = | = {{Widget:Liens-enseignement-Fiche}} = | ||
| Ligne 192 : | Ligne 174 : | ||
<!-- ****************** Commercez les modifications ************************** --> | <!-- ****************** Commercez les modifications ************************** --> | ||
| − | * | + | * Utilisation des modèles moléculaires |
| − | :* | + | :* Suivre le déroulement des réactions par des méthodes spectroscopiques ou par des dosages. |
| − | + | ||
| − | |||
}}<!-- ************************* Fin Idées-Enseignement ********************** --> | }}<!-- ************************* Fin Idées-Enseignement ********************** --> | ||
| − | |||
== {{Widget:Aides et astuces-Fiche}} == | == {{Widget:Aides et astuces-Fiche}} == | ||
| Ligne 209 : | Ligne 189 : | ||
<!-- ****************** Commercez les modifications ************************** --> | <!-- ****************** Commercez les modifications ************************** --> | ||
| − | * | + | * Equilibre les équations des réaction en conservant le nombre des atomes de chaque élément. |
| − | :* | + | :*L'avancement final n'est pas toujours égal à l'avancement maximal |
| − | + | ||
| − | |||
}}<!-- ************************* Fin Astuces-Enseignement ********************** --> | }}<!-- ************************* Fin Astuces-Enseignement ********************** --> | ||
| Ligne 224 : | Ligne 203 : | ||
<!-- ****************** Commercez les modifications ************--> | <!-- ****************** Commercez les modifications ************--> | ||
| − | :* ... | + | :* http://blog.ac-versailles.fr/1s4meudon/public/physique/re_capitulatif_avancement.pdf |
| − | :* ... | + | :* https://uel.unisciel.fr/chimie/chimther/chimther_ch01/co/apprendre_ch1_06.html |
| − | + | ||
}}<!-- ************ Fin Liens Education ********************** --> | }}<!-- ************ Fin Liens Education ********************** --> | ||
| Ligne 240 : | Ligne 219 : | ||
<!-- ****************** Commercez les modifications *********************--> | <!-- ****************** Commercez les modifications *********************--> | ||
| − | * ... | + | * https://uel.unisciel.fr/chimie/chimther/chimther_ch01/co/apprendre_ch1_06.html |
| − | * ... | + | * https://www.camerecole.org/classes/580-l-avancement-d-une-reaction-chimique.html |
| − | * ... | + | *https://www.maxicours.com/se/cours/l-avancement-d-une-reaction-chimique/#:~:text=En%20cours%20de%20r%C3%A9action%2C%20l,r%C3%A9action%20n'avance%20plus). |
| − | + | ||
}}<!-- ************* Fin Fiche Didactique Bibliographie *************** --> | }}<!-- ************* Fin Fiche Didactique Bibliographie *************** --> | ||
{{Widget:Fiche-Conceptuelle-Bas}} | {{Widget:Fiche-Conceptuelle-Bas}} | ||
Version actuelle datée du 7 février 2023 à 08:29
 Traduction
Traduction
Avancement d'une réaction (Français)
/ Progress of a chemical reaction (Anglais)
/ تقدم التفاعل الكيميائي (Arabe)
 Définition
Définition
Domaine, Discipline, Thématique
Définition écrite
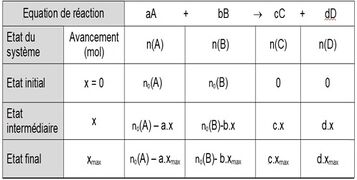
- L'avancement d'une réaction est une grandeur notée x qui s'exprime en mole. Il caractérise l'évolution d'une réaction chimique entre son état initial et son état final
- A l'état initial l'avancement d'une réaction chimique est 0.
A l'état final la valeur de l'avancement est x<f>
|
Définition graphique
 Concepts ou notions associés
Concepts ou notions associés
 Exemples, applications, utilisations
Exemples, applications, utilisations
|
 Erreurs ou confusions éventuelles
Erreurs ou confusions éventuelles
 Questions possibles
Questions possibles
 Liaisons enseignements et programmes
Liaisons enseignements et programmes
Idées ou Réflexions liées à son enseignement
- Utilisation des modèles moléculaires
- Suivre le déroulement des réactions par des méthodes spectroscopiques ou par des dosages.
Aides et astuces
Education: Autres liens, sites ou portails
 Bibliographie
Bibliographie
Pour citer cette page: (d'une réaction)
ABROUGUI, M & al, 2023. Avancement d'une réaction. In Didaquest [en ligne]. <http:www.didaquest.org/wiki/Avancement_d%26%2339;une_r%C3%A9action>, consulté le 21, novembre, 2024
- https://uel.unisciel.fr/chimie/chimther/chimther_ch01/co/apprendre_ch1_06.html
- https://www.camerecole.org/classes/580-l-avancement-d-une-reaction-chimique.html
- https://www.maxicours.com/se/cours/l-avancement-d-une-reaction-chimique/#:~:text=En%20cours%20de%20r%C3%A9action%2C%20l,r%C3%A9action%20n'avance%20plus).