Différences entre versions de « Avancement d'une réaction »
De Didaquest
Aller à la navigationAller à la recherche| Ligne 158 : | Ligne 158 : | ||
<!-- ************ Commercez les modifications *********************--> | <!-- ************ Commercez les modifications *********************--> | ||
| − | * | + | * Une réaction est elle toujours totale ? |
| − | * | + | * C'est quoi une réaction partielle ? |
}}<!-- ******** Fin Fiche Didactique Questions ******************* --> | }}<!-- ******** Fin Fiche Didactique Questions ******************* --> | ||
Version du 15 janvier 2023 à 23:02
 Traduction
Traduction
Avancement d'une réaction (Français)
/ Progress of a chemical reaction (Anglais)
/ تقدم التفاعل الكيميائي (Arabe)
 Définition
Définition
Domaine, Discipline, Thématique
Définition écrite
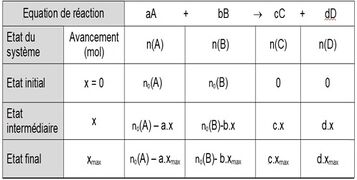
- L'avancement d'une réaction est une grandeur notée x qui s'exprime en mole. Il caractérise l'évolution d'une réaction chimique entre son état initial et son état final
- A l'état initial l'avancement d'une réaction chimique est 0.
A l'état final la valeur de l'avancement est x<f>
|
Définition graphique
 Concepts ou notions associés
Concepts ou notions associés
 Exemples, applications, utilisations
Exemples, applications, utilisations
|
 Erreurs ou confusions éventuelles
Erreurs ou confusions éventuelles
 Questions possibles
Questions possibles
 Liaisons enseignements et programmes
Liaisons enseignements et programmes
Idées ou Réflexions liées à son enseignement
Aides et astuces
Education: Autres liens, sites ou portails
 Bibliographie
Bibliographie
Pour citer cette page: (d'une réaction)
ABROUGUI, M & al, 2023. Avancement d'une réaction. In Didaquest [en ligne]. <http:www.didaquest.org/wiki/Avancement_d%26%2339;une_r%C3%A9action>, consulté le 24, novembre, 2024
- ..................
- ..................
- ..................
- ..................