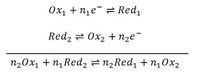Différences entre versions de « L'équation globale de l'oxydoréduction »
De Didaquest
Aller à la navigationAller à la recherche| Ligne 34 : | Ligne 34 : | ||
[[Fichier:rdx01.jpg |200 px|Titre de la définition graphique 1]]<!-- Remplacer et adapter le contenu --> | [[Fichier:rdx01.jpg |200 px|Titre de la définition graphique 1]]<!-- Remplacer et adapter le contenu --> | ||
[[Fichier:rdx02.jpg |200 px|Titre de la définition graphique 2]]<!-- Remplacer et adapter le contenu --> | [[Fichier:rdx02.jpg |200 px|Titre de la définition graphique 2]]<!-- Remplacer et adapter le contenu --> | ||
| − | [[Fichier: | + | [[Fichier:rdx03.jpg |200 px|Titre de la définition graphique 3]]<!-- Remplacer et adapter le contenu --> |
{{Widget:Fin-cadre-Bleu}} | {{Widget:Fin-cadre-Bleu}} | ||
Version du 17 janvier 2017 à 22:50
 Traduction
Traduction
L'équation globale de l'oxydoréduction (Français) / The global equation of redox (Anglais) / المعادلة العامة للأكسدة (Arabe)
 Définition
Définition
- Domaine, Discipline, Thématique :
Catégorie: Chimie générale / Catégorie: Électrochimie / Catégorie: Métallurgie
Définition écrite
C'est la somme de deux demi-réactions, celle d'oxydation et celle de réduction au cours du quelle il y a un transfert d'électrons.
Dans une réaction d'oxydoréduction, l'oxydant et le réducteur forme un couple lié par un échange d'électrons |
Définition graphique
 Concepts ou notions associés
Concepts ou notions associés
 Exemples, applications, utilisations
Exemples, applications, utilisations
- Pile électrochimique
- Corrosion
 Erreurs ou confusions éventuelles
Erreurs ou confusions éventuelles
- A ne pas confondre la demi-réaction d'oxydation ou de réduction avec la demi réaction d'oxydoréduction
- On doit vérifier si le nombre d'électrons donnés est égal au nombre d’électrons reçus
 Questions possibles
Questions possibles
- Comment arrive-t-on à équilibrer l'équation totale de réaction redox?
- Comment procéder pour additionner les deux demi-équations de réactions en une seule équation?
 Liaisons enseignements et programmes
Liaisons enseignements et programmes
- Portail Formation Gratuite
- Multisites Educatifs
- Sur DidaQuest
- Sur le Portail Didactique.info
- Sur le Portail Questions / Réponses
- Concept Sur Wikipedia
- Concept Sur Wikiwand
- Concept Sur Wikiversity
 Aides, Astuces,...
Aides, Astuces,...
Un échange d'électrons entre des réactifs a toujours lieu dans une réaction d'oxydoréduction. Ainsi, le réactif qui gagne des électrons est nommé oxydant puisqu'il cause l'oxydation d'une autre substance. À l'inverse, le réactif qui perd des électrons est nommé réducteur puisqu'il cause la réduction de l'autre substance.
=
 Difficultés liées à son enseignement =
Difficultés liées à son enseignement =
 Liens Internet
Liens Internet
- URL :
- URL :