Différences entre versions de « Couches électroniques »
| Ligne 49 : | Ligne 49 : | ||
<!-- Remplacer et adapter le contenu --> | <!-- Remplacer et adapter le contenu --> | ||
| − | [[atome]] / [[électrons]] / [[noyau] | + | [[atome]] / [[électrons]] / [[noyau]] |
Version actuelle datée du 26 janvier 2017 à 20:45
 Traduction
Traduction
Couches électroniques (Français) / Electronic layers (Anglais) / طبقات الإلكترونية (Arabe)
 Définition
Définition
- Domaine, Discipline, Thématique :
Catégorie: Sciences physiques / Catégorie: chimie / Catégorie: la matière
Définition écrite
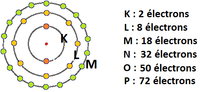
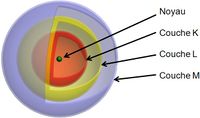
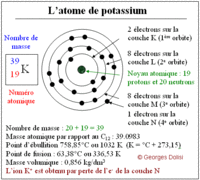
Les couches électroniques sont notées K, L, M, N, O ... Dans une première approximation, on peut considérer qu'une même quantité d'énergie est nécessaire pour arracher deux électrons situés sur une même couche. Les couches électroniques sont désignées par des lettres de l'alphabet. La couche K est la plus proche du noyau. Puis viennent les couches L, M, etc. Un nombre maximum d’électrons sur chaque couche électronique Le nombre maximum d'électrons que peut contenir chaque couche électronique est défini par le principe de Pauli. Il est défini par la formule suivante : 2n² où n représente le nombre quantique attribué à la couche en question. Ainsi, par exemple, la couche K peut contenir 2 x 12 = 2 électrons. Et la couche L, 2 x 22 = 8 électrons. Une couche électronique remplie est dite saturée. Lorsque l'atome se trouve dans son état fondamental, les électrons remplissent les couches « dans l'ordre alphabétique »
|
Définition graphique
 Concepts ou notions associés
Concepts ou notions associés
 Exemples, applications, utilisations
Exemples, applications, utilisations
- Exemples :
L'oxygène, par exemple, compte huit électrons qui se répartissent de la façon suivante : (K)2(L)6.
Ecrire la structure ou formule électronique d’un atome ou d’un ion, c’est indiquer la répartition
des électrons sur les différentes couches. Exemples : L’atome Na a un numéro atomique ou nombre de charge Z=11. Il comporte donc 11 protons dans son noyau, et par conséquent 11 électrons dans son nuage électronique. La formule électronique de l’atome est donc : (K)2(L)8(M)1. De même, pour l’atome C, Z=6 : (K)2(L)4.
Autre exemple, l’ion Cl- : Le numéro atomique de Cl est Z=17. L’atome Cl comporte donc 17 protons dans le noyau, 17 électrons dans le nuage. Cl-est un atome Cl qui a gagné un électron supplémentaire, il en possède donc 18. La formule électronique de Cl- est donc (K)2(L)8(M)8.
- Remarque :
pour gagner en stabilité les atomes cherchent à remplir leur couche électronique (couche par couche). c'est à dire obéir soit à la règle de duet ou de l'octet. exemples :
l' atome de Lithium a 3 électrons tel que :
2 électrons sur la couche K 1 électron sur la couche L Pour être stable cet atome va se transformer en ion de structure électronique :
2 électrons sur la couche K 0 électron sur la couche L Cet atome devient stable en perdant un électron. Il devient un ion chargé positivement (1 fois plus). C’est alors un cation.
L'atome de Chlore a 17 électrons répartis :
2 électrons sur la couche K 8 électrons sur la couche L 7 électrons sur la couche M Pour être stable l’atome va se transformer en ion de structure électronique :
2 électrons sur la couche K 8 électrons sur la couche L 8 électrons sur la couche M Cet atome devient stable en gagnant un électron. Il devient un ion chargé négativement (1 fois moins). C’est alors un anion. Cet atome peut aussi échanger un électron avec un autre atome. Lors de cet échange est créée une liaison covalente (mise en commun d’une paire d’électron). Ainsi, l’atome récupère par une mutualisation (misen commun) l’électron qui lui manquait.
 Erreurs ou confusions éventuelles
Erreurs ou confusions éventuelles
- Il y a confusion entre la configuration électronique, qui désigne le nombre d'électrons sur chaque sous-couche électronique, et la répartition des électrons sur les sous-couches incomplètes.
 Questions possibles
Questions possibles
- Question: comment sont répartis les électrons de l'atome X sur les différentes couches électroniques?
 Liaisons enseignements et programmes
Liaisons enseignements et programmes
- Portail Formation Gratuite
- Multisites Educatifs
- Sur DidaQuest
- Sur le Portail Didactique.info
- Sur le Portail Questions / Réponses
- Concept Sur Wikipedia
- Concept Sur Wikiwand
- Concept Sur Wikiversity
 Aides, Astuces,...
Aides, Astuces,...
- N.B : Pour remplir la troisième ligne du tableau périodique (c’est-à-dire la couche M), on arrête le remplissage à 8 électrons. Viendra ensuite le remplissage de la quatrième ligne en commençant à remplir dans un premier temps la couche N jusqu’à 2 électrons puis on reprendra le remplissage de la couche M jusqu’à 18 électrons pour revenir à remplir la couche N jusqu’à 8 électrons (alors qu’elle peut contenir 32 électrons)... On passera alors au remplissage de la 5ème ligne et donc de la couche O... Mais finalement, en enseignement secondaire nous nous arrêterons au remplissage des trois premières lignes du tableau périodique et donc au remplissage des couches K, L et M (avec 8 électrons au maximum sur cette dernière pour nous arrêter aux trois premières lignes du tableau périodique).
=
 Difficultés liées à son enseignement =
Difficultés liées à son enseignement =
dans la 3eme ligne on ne peut pas appliquer cette règle et le nombre maximal est 8 comme dans la 2eme ligne et ça pose des problèmes chez les élèves
 Liens Internet
Liens Internet