Atome
 Traduction
Traduction
atome (Français) / atom (Anglais) / ذرة (Arabe)
 Définition
Définition
- Domaine, Discipline, Thématique :
Catégorie: Sciences PhysiquesCatégorie: Physique / Catégorie: Chimie / Catégorie: électronique / Catégorie: électricité / Catégorie: électromagnétisme / Catégorie: Physique atomique nucléaire / Catégorie: la matière
Définition écrite
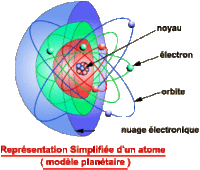
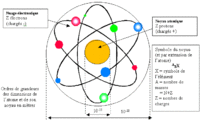
L’atome est le constituant fondamental de la matière. Un corps constitué d'atomes de même espèce est appelé corps simple ou élément chimique. Composition: - un noyau de nucléons : protons et neutrons concentrant pratiquement toute la masse de l'atome, - des électrons minuscules, orbitant très loin du noyau.
* Taille de l'atome: Un atome a une taille de l'ordre de 10 ^-10m, soit un dixième de millionième de millimètre ! Un noyau d'atome a une taille de l'ordre de 10^-15m, soit cent mille fois plus petit que l'atome lui-même ! Un électron est théoriquement une particule ponctuelle, elle ne doit donc pas avoir de taille... En tout cas, si l'électron a une taille, elle est inférieure à 10^-18m, soit au moins cent millions de fois plus petit que l'atome ! Un atome est donc très petit: il y a onze milliards de milliards d'atomes de fer dans un milligramme de fer ! Le plus petit atome est celui d'hydrogène: 1 seul proton, 1 électron. Certains ordres de grandeur sont également à connaître: Tous les électrons sont identiques quels que soient les atomes auxquels ils appartiennent : leur masse est d'environ 10 -30 kg (exactement 9,1 x 10 -31 kg) Les noyaux sont par contre tous différents mais leur taille est de l'ordre de 10 -15 m (elle varie quelque peu selon les atomes) Les atomes ont un diamètre de l'ordre de 10^-10 m ( il varie selon les atomes) Un atome est donc environ 10^5 (100000) fois plus grand que son noyau : si le noyau était un ballon de foot de 20 cm de diamètre, l'atome correspondant serait une sphère de 20 km ! 99,97 % de la masse de l'atome est concentrée dans le noyau Le volume de l'atome est constitué à 99,9999999999999% de vide: si l'on pouvait enlever le vide des atomes constituant la Terre, toute la matière serait contenue dans une sphère de 150 m de rayon. * masse d'un atome: La masse d'un nucléon est de 1,7 10^-27kg, soit moins de deux millièmes de milliardième de milliardième de milligramme ! Les protons et les neutrons ont quasiment la même masse. La masse d'un électron est de 9,1 10^-31kg, soit 1836 fois moins qu'un nucléon ! Ainsi, 99,97% de la masse d'un atome est dans son noyau ! Comme le noyau est très petit, la masse d'un atome est donc très concentrée. Ainsi, si on supprimait le vide qu'il y a autour des noyaux des atomes, la Terre pourrait tenir dans une sphère de seulement 180m de rayon !
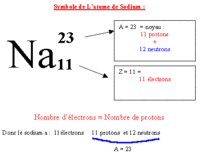
Les unités de base de la chimie sont des atomes. Au cours des réactions chimiques les atomes sont conservés en tant que tels, ne sont pas créés ni détruits, mais sont organisés différemment créent des liens différents entre un atome et un autre. Les atomes sont regroupés pour former des molécules et d'autres types de matériaux. Chaque type de molécule est la combinaison d'un nombre d'atomes liés entre eux d'une manière spécifique. Selon la composition de chaque atome représenté des éléments chimiques différents de la classification périodique des éléments chimiques différents. Dans ce tableau, nous pouvons trouver le numéro atomique et le nombre de masse de chaque élément: Le numéro atomique est représentée par la lettre Z indique le nombre de protons ayant un atome, qui est égal au nombre d'électrons comme l'atome est électriquement neutre . Tous les atomes ayant le même nombre de protons appartiennent au même élément et possèdent les mêmes propriétés chimiques. Par exemple, tous les atomes avec un proton sont un atome d'hydrogène (Z = 1), tous les atomes avec deux protons est l'hélium (Z = 2). Le nombre de masse est représentée par la lettre A, et se réfère à la somme des protons et des neutrons qui contient l'élément. Les isotopes sont deux atomes ayant le même nombre de protons mais un nombre différent de neutrons. Isotopes du même élément, ont une des propriétés chimiques et physiques très semblables les uns aux autres. * comment a-t-on découvert la structure de l'atome? On n'a commencé à dévoiler la structure des atomes qu'à partir de 1895, par la découverte des rayons X par Röntgen en 1895 puis de la radio-activité par Henri Becquerel en 1896 et Pierre et Marie Curie à partir de 1898 qui a permis de commencer à comprendre la structure des atomes. Les électrons ont été identifiés par J. J. Thomson en 1897, puis, en 1911, Ernest Rutherford met en évidence l'existence du noyau atomique, puis la notion de proton s'impose peu à peu. Cependant, pendant plusieurs années, les physiciens pensaient que le noyau était formé de protons et d'électrons. Dans le même temps, pendant les années 1924-27, le développement de la mécanique quantique permet de décrire de manière précise le comportement des électrons des atomes. Seul le noyau restait incompris... En 1931, Irène et Frédéric Joliot-Curie observent les neutrons mais sans comprendre leur nature. En 1932, James Chadwick montre que le neutron est un partenaire neutre du proton. La structure de l'atome est comprise... Que signifie le mot atome ? et quel est son origine ? Le mot atome vient du grec "atomos" qui signifie indivisible, insécable. Il convenait donc parfaitement au concept d'atome lorsqu'il a été élaboré par les chimistes au début du XIXème siècle, c'est à dire comme la plus petite partie d'un corps pur. Maintenant, on sait que les atomes ne sont pas indivisibles, qu'on peut en arracher des électrons, fissionner leur noyau, etc... Ils sont constitués de particules encore plus petites, appelées particules subatomiques.Mais le nom est resté !
La matière est électriquement neutre car elle possède autant de porteurs de charges négatives (électrons) que de porteurs de charges positives (protons). -Par électrisation, l’atome peut gagner ou céder un ou plusieurs électrons et devenir un ion simple chargé négativement appelé anion ou chargé positivement dit cation. |
Définition graphique
 Concepts ou notions associés
Concepts ou notions associés
|
|
 Exemples, applications, utilisations
Exemples, applications, utilisations
- la réaction chimique
- l'énergie nucléaire.
- Médecine nucléaire
 Erreurs ou confusions éventuelles
Erreurs ou confusions éventuelles
Il faut distinguer entre un atome et un élément chimique . en effet : Deux atomes peuvent avoir un même nombre de protons, mais un nombre différent de neutrons. Ce sont alors des isotopes. Les particules sont souvent mal représentées dans les croquis. Aucune différenciation n'est faite entre les atomes et les molécules. Les particules possèdent les mêmes propriétés que les matériaux qu'elles composent. Par exemple, les atomes de cuivre sont "orange et brillant", les molécules de gaz sont transparentes et celles des solides sont durs.
 Questions possibles
Questions possibles
quelle est la charge électrique d'un atome ? Quelle sont l'ordre de grandeur de taille et de masse de l'atome ? Comment l'atome forme la matière ? Quelle est la forme géométrique d'un atome ?
 Liaisons enseignements et programmes
Liaisons enseignements et programmes
1- Il faut introduire la discontinuité de la matiere . 2- introduire le modèle de système solaire de l'atome introduit par Niels Bohr et Ernest Rutherford au XXe siècle. 3- Expliquez que les orbites des électrons autour du noyau sont plus des orbites spécifiques comme les nuages, et que le nuage représente l'emplacement plus probable de l'électron à un moment donné.
Toutefois, le modèle de système solaire demeure un moyen efficace de visualiser un atome.
- Portail Formation Gratuite
- Multisites Educatifs
- Sur DidaQuest
- Sur le Portail Didactique.info
- Sur le Portail Questions / Réponses
- Concept Sur Wikipedia
- Concept Sur Wikiwand
- Concept Sur Wikiversity
 Aides, Astuces,...
Aides, Astuces,...
=
 Difficultés liées à son enseignement =
Difficultés liées à son enseignement =
Il n'y a pas d’explicitation du modèle et les différences entre les modèles enseignés de l'atome créent une confusion chez les élèves. Ça reste quelque chose de jamais vu.
 Liens Internet
Liens Internet
 Bibliographie
Bibliographie
- /