Spectre atomique
 Traduction
Traduction
Spectre atomique (Français) / Atomic spectrum (Anglais) / الطيف الذري (Arabe)
 Définition
Définition
- Domaine, Discipline, Thématique :
Catégorie: Sciences physiques / Catégorie: Physique / Catégorie: Physique atomique nucéaire
Définition écrite
|
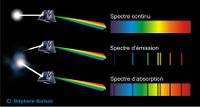
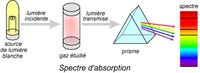
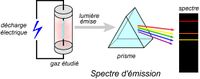
Les spectres atomiques sont de deux types : absorption et émission. Spectres d’absorption : Le spectre d'absorption est un spectre discontinu formé par des raies noires (cannelures) sur un fond coloré qui correspond au spectre visible de la lumière blanche. La lumière traverse un échantillon (dans son état fondamental) et on observe à l’issue de cette traversée un spectre d’absorption. Spectres d’émission : Le spectre d'émission est un spectre discontinu formé par des raies colorées sur un fond noir. On excite la matière qui émet, pour retourner à son état stable, une lumière.
|
Définition graphique
 Concepts ou notions associés
Concepts ou notions associés
 Exemples, applications, utilisations
Exemples, applications, utilisations
- Spectre de l’atome d’hydrogène :
Sous l’effet du champ électrique intense crée entre les électrodes de l’ampoule, l’atome d’hydrogène subit une déformation due aux forces opposées qui s’exercent simultanément sur l’électron et le proton. Le champ électrique fournit alors de l’énergie à l’atome d’hydrogène ce qui permet à l’électron de passer du niveau E1 au niveau supérieur Ei , l’atome passe alors de son état fondamental à un état excité qui est instable . L'état excité n'est pas un état stable pour l'atome, il n'y reste que pour un court instant environ égal à 10^-8 s. On remarque que ce spectre comporte des raies noires dont les longueurs d'ondes sont identiques à celles présentes dans le spectre d'émission du même gaz.
 Erreurs ou confusions éventuelles
Erreurs ou confusions éventuelles
- il faut distinguer entre le spectre d'absorption et d'emission
- Pour trouver le nombre de raies que l’on peut créer pour un nombre de niveaux donnés quand il n’y a pas de transition interdite beaucoup d’éleves ajoutent un niveau chaque fois qu’ils veulent créer une raie.
L'énergie ici est négative alors que pour eux c'est une grandeur positive
 Questions possibles
Questions possibles
- Questions:
Qu'elles sont les propriétés élémentaire de l'électron? Dans quel élément de la matière se situe un électron ? Dans quel sens se déplacent les électrons dans le courant électrique?
 Liaisons enseignements et programmes
Liaisons enseignements et programmes
- Portail Formation Gratuite
- Multisites Educatifs
- Sur DidaQuest
- Sur le Portail Didactique.info
- Sur le Portail Questions / Réponses
- Concept Sur Wikipedia
- Concept Sur Wikiwand
- Concept Sur Wikiversity
 Aides, Astuces,...
Aides, Astuces,...
calculer les énergies des raies ce qui oblige les eleves à « s’approprier » la formule A partir de la formule de Rydberg et du schéma des niveaux, on pourrait identifier le numéro de niveau avec le nombre quantique principal. Dans ce cas, on obtiendrait l’énergie des niveaux et la limite de dissociation pour n = +∞.
=
 Difficultés liées à son enseignement =
Difficultés liées à son enseignement =
Il est difficile d'introduire la discontinuité de l'énergie. Le modèle utilisé pose une difficulté chez les élèves car ils ont une conception du modèle de Rutherford et Bohr de l'atome il est difficile de montrer la nécessité de définir une origine des énergies. la relation de Balmer-Rydberg ne fait pas intervenir le niveau fondamental.
 Liens Internet
Liens Internet
- URL :
- URL :