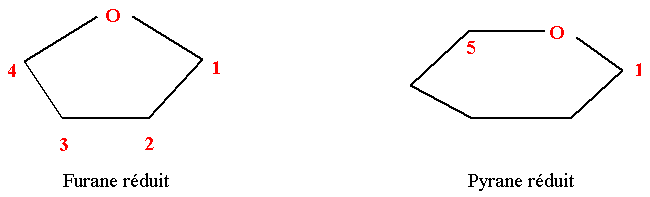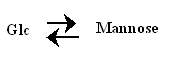Glucides - Biochimie - Dossier
Définition
- Les glucides sont des molécules organiques dont les carbones sont porteurs
- - de fonctions alcools (alcool secondaire, alcool primaire);
- - d’une fonction aldéhyde ou cétonique (fonction carbonylique);
- - parfois d’une fonction acide ou aminée.
Au total, il s’agit d’aldéhyde ou de cétone polyhydroxylées car un carbone est porteur soit d’un aldéhyde soit d’une cétone, tous les autres carbones étant porteurs de fonctions alcools.
Rôle
Les glucides jouent plusieurs rôles capitaux pour les organismes vivants: production énergétique ou mise en réserve, synthèse de glycoprotéines et de macromolécules (GAG, …), synthèse des nucléotides (ribose et NADPH), épuration des produits insolubles et toxiques, interrelation métabolique.
I) Mise en place générale
Rôle énergétique et de réserve
- Par exemple, 40 à 50 % des calories apportées par l’alimentation humaine sont des glucides.
- Ils servent de réserve énergétique sous forme polymérisée : amidon et glycogène. Par exemple l'amidon est la forme principale d'accumulation de l'énergie photosynthétique dans la biosphère. Chez les mammifères le rôle de réserve énergétique dans est localisé dans le foie et les muscles (glycogène).
Rôle structural
Ils jouent un rôle d'élément de structure de la cellule: les mucopolysaccharides chez les animaux supérieurs, la cellulose chez les végétaux. Les glucides interviennent comme :
- Eléments de soutien (cellulose), de protection et de reconnaissance dans la cellule.
- Eléments de réserve des végétaux et animaux (glycogène, amidon, inuline).
- Constituants de molécules fondamentales : acides nucléiques, coenzymes, vitamines, …
- Ils représentent un fort pourcentage de la biomasse car la plus grande partie de la matière organique sur la Terre est glucidique.
Rôle de communication
Ils interviennent comme éléments de reconnaissance et de communication entre cellules : les polyosides des groupes sanguins, les polyosides antigéniques des bactéries.
Rôle biochimique
- Les glucides sont les précurseurs de nombreux processus biochimiques (Glycolyse, cycle de Krebs, voie des pentoses-phosphates, voie du 2,3-diphosphoglycérate,métabolisme des lipides et des protéines,..)
- Les glucides font partie intégrante de la structure de nombreuses macromolécules biologiques fondamentales telles que les glycoprotéines, les acides nucléiques (ribose et désoxyribose), les coenzymes et les antibiotiques.
Rôle économique
- Cellulose : milliards de tonnes / an
- Amidon, saccharose : millions de tonnes / an.
Place du glucose
- Principal carburant des tissus
- Seul carburant du fœtus
- Rôle fondamental car tous les glucides alimentaires sont absorbés sous forme de glucose ou convertis en glucose dans le foie.
- Tous les glucides peuvent être synthétisés à partir du glucose dans l’organisme.
Le glucose est un carrefour métabolique des glucides
Classification
On distingue les oses et les osides.
Critères de classification des oses
Ces critères font appel au nombre d’atomes de carbone de l’ose et à la nature du carboxyle.
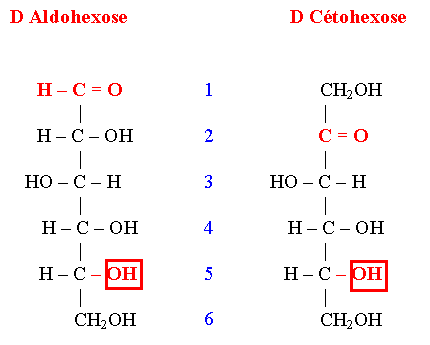
- Le nombre d’atomes de carbone : 3C (triose) ; 6C (hexose)
- La nature du carbonyle : Aldéhyde → Aldose ; Cétone → Cétose
- La combinaison de ces 2 critères caractérise l’ose :
- * Aldopentose, Aldohexose, …
- * Cétopentose, Cétohexose, …
Osides
Définition
Ce sont des molécules dont l’hydrolyse fournit 2 ou plusieurs molécules d’oses. Ces oses sont identiques ou différents. On en distingue 2 grands groupes : Holosides et Hétérosides.
Holosides
- Liaison de n molécules d’oses par des liaisons glycosidiques.
- Selon le nombre d’oses constitutifs : Di-, Tri, Tétra … holosides.
- Oligosides : jusqu’à quelques dizaines d’oses.
- Polyosides : quelques centaines d’oses (cellulose, amidon).
Hétérosides
- Ils donnent par hydrolyse : oses + aglycone (partie non sucrée).
- Liaison à des Protéines (glycoprotéines), à des Lipides (glycolipides), à des bases.
Oses
Structure linéaire des oses
Nomenclature
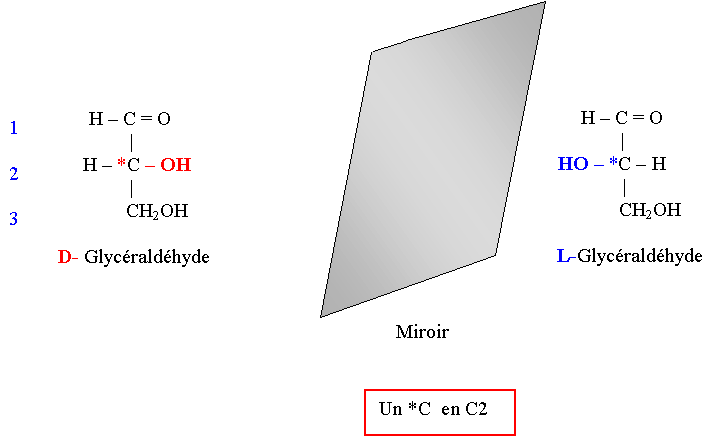
Structure du Glycéraldéhyde
Rappels sur le Carbone asymétrique
- 1- Il est porteur de 4 radicaux différents (exemple : C2 du glycéraldéhyde)
- 2- Isomères optiques ou énantiomères
- Isomère dextrogyre (+)
- Isomère lévogyre (-)
- Mélange équimoléculaire des 2 isomères : Racémique (DL) inactif sur la lumière polarisée.
- 3- Une molécule chirale est une molécule optiquement active :
- Elle renferme au moins 1 C asymétrique
- Elle n’a pas de plan de symétrie.
- 4- Configuration stéréochimique et pouvoir rotatoire d’un ose
En dehors du glycéraldéhyde, il n’y a aucune relation entre configuration stéréochimique de l’ose et son pouvoir rotatoire.
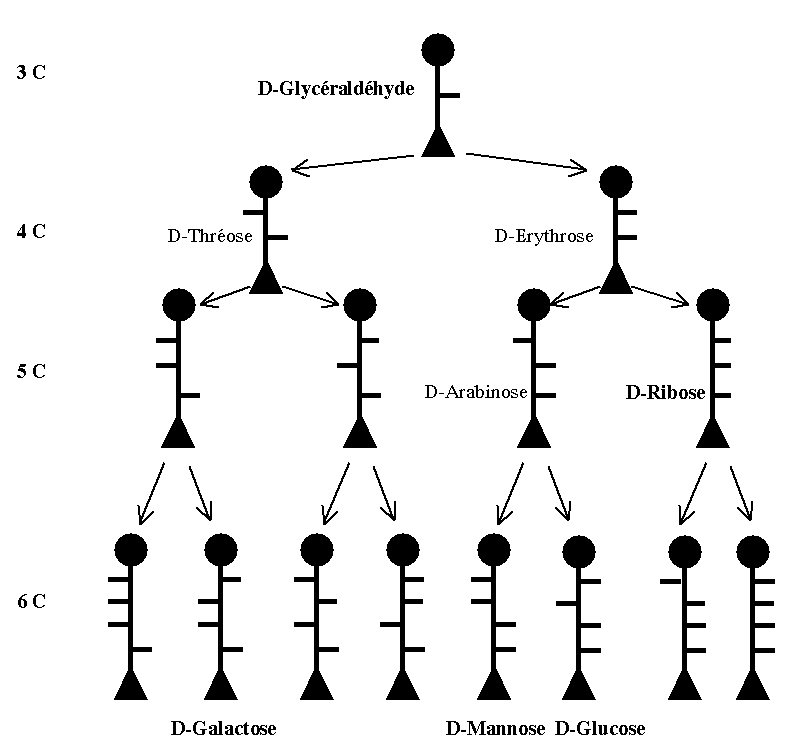
Filiation chimique des oses selon Fischer
- 1- Formation à partir du D-Glycéraldéhyde (par addition de C successifs)
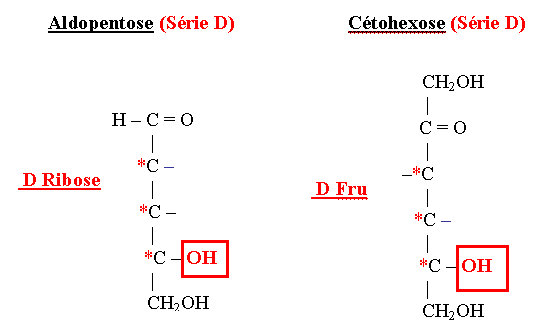
Série D et L des oses
- 1- Oses de la série D
- Ils sont rattachés au D-Glycéraldéhyde : la configuration spatiale de l’hydroxyle porté par le C subterminal de l’ose (ou Carbone n-1) est identique à celle du D-Glycéraldéhyde.
- La plus grande majorité des oses naturels sont de la série D.
- 2- Oses de la série L
- Ils dérivent par voie chimique du L-Glycéraldéhyde.
Par addition successive d’un carbone, on obtient à chaque étape la formation de 2 isomères (1 triose → 2 tétroses → 4 pentoses → 8 hexoses).
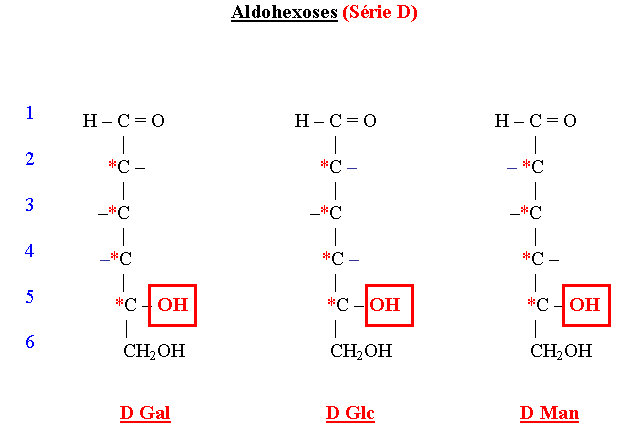
Principaux oses naturels selon Fischer
- Epimères
- L’épimérisation se fait par voie chimique ou enzymatique (épimérase).
- Le Galactose est épimère en 4 du Glucose. L’absence d’épimérase empêche la transformation du Galactose en Glucose et entraîne une des formes de la galactosémie congénitale du nouveau-né.
- Le Mannose est épimère en 2 du Glucose (c’est un épimère chimique = épimère vrai).
Objections à la structure linéaire des oses
- En solution dans l’eau, les oses existent sous forme cyclique
- Nous citerons deux objections à la structure linéaire :
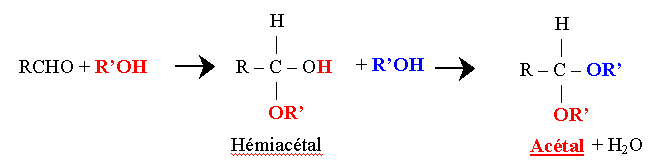
- 1- Formation d’Acétal
- Un aldose ou une cétone vrais fixe deux molécules d’alcool
- Un aldose ou un cétose ne fixent qu’une seule molécule d’alcool
- 2- Mutarotation (anomères)
La valeur du pouvoir rotatoire d’un ose (mesurée au polarimètre) n’est pas fixée immédiatement ; elle le devient au bout d’un certain temps. Ce phénomène est lié à l’existence de 2 formes isomériques, l’anomère α ou β à l’origine de la mutarotation. Ces 2 anomères différent par la position dans l’espace du OH hémiacétalique.
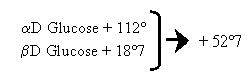
- 3- Ces objections permettent de montrer qu’en solution les oses existent non pas sous forme linéaire mais sous forme cyclique.
Structure cyclique des oses : structure de Haworth
Le cycle est formé par une liaison dans la molécule d’ose entre la fonction carbonylique (aldéhyde ou cétone) et un OH alcoolique := liaison hémiacétalique.
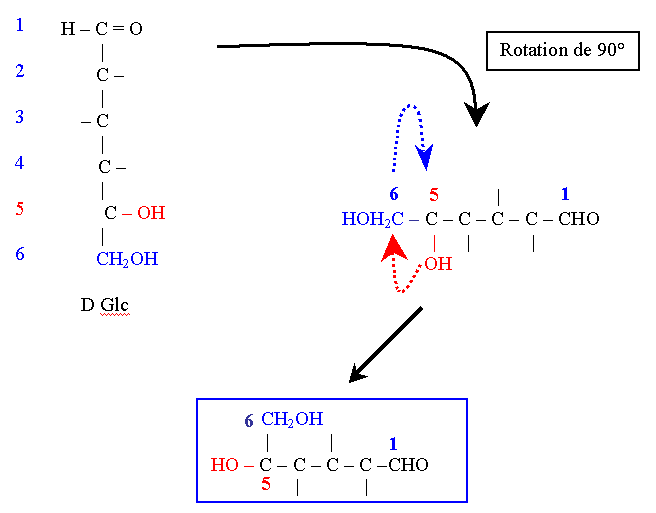
La structure est convexe vers l’observateur.
Par cette convexité les C1 et C6 sont proches dans l’espace. La rotation des valences autour du C5 permet de mettre sur un même plan les atomes participant à la cyclisation, soit : le C1, le C5 et l’Oxygène du C5.
Le cycle à 6 sommets qui en résulte est appelé pyranique car il est issu du pyrane.
Intérêt de la structure cyclique
La structure cyclique explique les objections à la structure linéaire des oses et les propriétés de ceux-ci :
- 1- La fonction aldéhyde ou cétonique de l’ose, partiellement dissimulée (hémiacétal), est appelée pseudoaldéhydique ou pseudocétonique.
- 2- Il existe un carbone asymétrique (C1 des aldoses ; C2 des cétoses) en raison de l’hémiacétalisation interne qui conduit à 2 anomères : α et β
- 3- L’anomère α a un OH hémiacétalique du même côté que le OH porté par le C subterminal qui détermine la série. Il a le pouvoir rotatoire le plus élevé.
L’anomère β a les propriétés inverses.
Structure cyclique des oses selon Haworth
Deux structures cycliques sont possibles.
- La forme pyranique correspond à un hérérocycle à 6 sommets (5 C et 1 O).
- La forme furanique correspond à un hétérocycle à 5 sommets (4 C et 1 O).
D Glucopyranose
- Le Glucose naturel (D (+) Glucose) est très répandu dans la nature. C’est le principal carburant de l’organisme et le carburant universel du fœtus.
- La polymérisation du Glucose conduit au Glycogène (foie, muscles).
- La glycémie est la concentration de Glucose à l’état libre dans le sang (0,80g/L soit 4,4 mM/L).
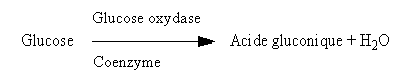
- Le Glucose est réducteur. La Glucose oxydase l’oxyde en acide aldonique :
- Son pouvoir rotatoire est dextrogyre.
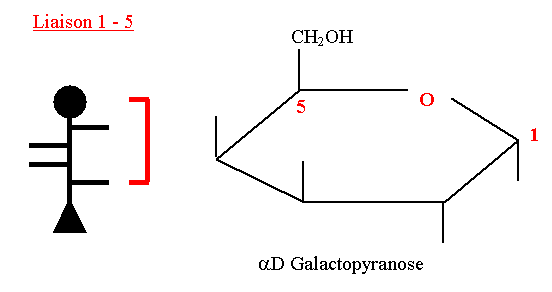
D-Galactopyranose
- Il intervient dans la composition de :
- Lactose = D Gal + D Glc
- Cérébrogalactosides du cerveau
- Certains glycolipides et glycoprotéines
- Son pouvoir rotatoire est dextrogyre.
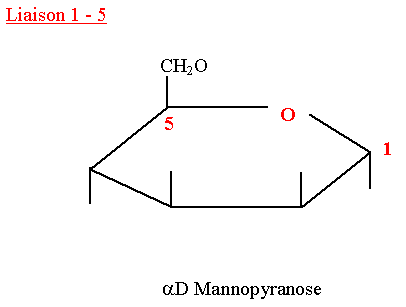
D-Mannopyranose
- Il est présent surtout dans les végétaux.
- C’est un constituant des glycoprotéines chez l’homme.
- Son pouvoir rotatoire est dextrogyre.
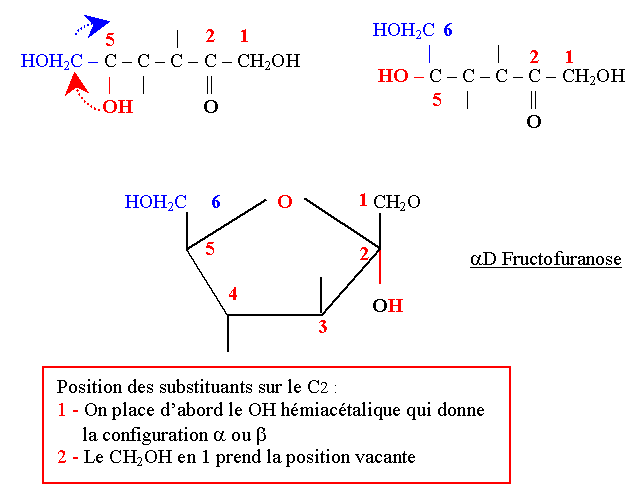
D-Fructofuranose
- On le trouve surtout dans les fruits d’où son nom.
- Son pouvoir rotatoire est lévogyre d’où son nom de Lévulose.
- Il est présent dans le liquide spermatique chez l’homme où il participe au mouvement des spermatozoïdes.
- Il est présent sous forme furanique dans le saccharose.
- La cyclisation se fait entre le C2 (cétone) et le C5.
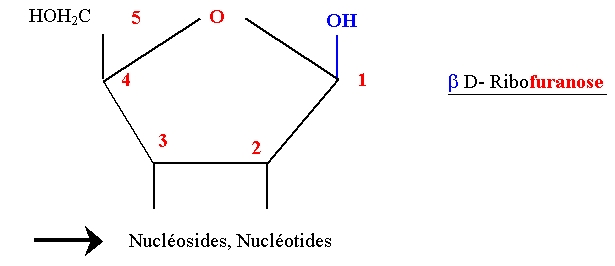
D Ribofuranose
- La forme furanique est la forme habituelle des pentoses combinés dans les acides nucléiques (ARN).
- Le βD Ribofuranose est lié aux bases puriques et pyrimidiques par une liaison N-osidique (nucléosides, nucléotides).
- Il intervient dans la structure des coenzymes : NAD, NADP, ATP.
- La forme biologique est la forme furanique (1 - 4)
Dans le Désoxyribose le OH en 2 est remplacé par H (ADN).
Principales propriétés des oses
- 1- Certains oses (fructose) ou osides (saccharose) ont un goût sucré.
- 2- Les oses sont très hydrosolubles en raison de leurs nombreuses fonctions alcooliques.
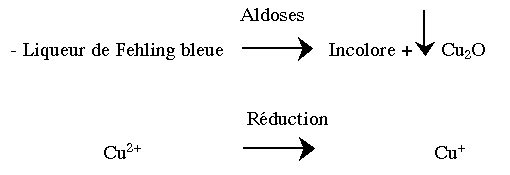
- 3- Les aldoses sont réducteurs par leur fonction hémiacétalique (pseudoaldéhydique). Les cétoses sont très peu réducteurs :
- 4- La Glucose oxydase oxyde spécifiquement le Glucose en acide gluconique.
- 5- Les oses se réduisent en polyols par voie chimique ou enzymatique
- La fonction aldéhydique ou cétonique est réduite en alcool
- Glucose => Glucitol (ou Sorbitol)
- Galactose => Galactitol (ou Dulcitol)
- Mannose => Mannitol
- Ribose => Ribitol
- Le Fructose donne 2 polyols car la réduction du C= O entraîne la formation d’un *C asymétrique :
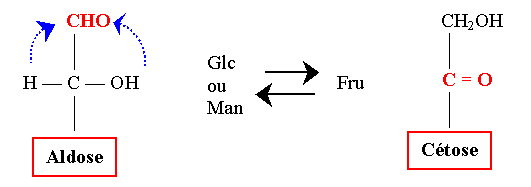
- 6- Les oses subissent une interconversion et une épimérisation en milieu alcalin.
- Interconversion
- Epimérisation : Epimères en C2 :
Comme nous l’avons vu précédemment, une épimérisation en 4 peut se faire par voie enzymatique grâce à une épimérase :
- 7- Les oses sont estérifiables : exemples du Glucose - 6 - Phosphate, du Fructose 1, 6 - bis Phosphate, molécules importantes du métabolisme énergétique.
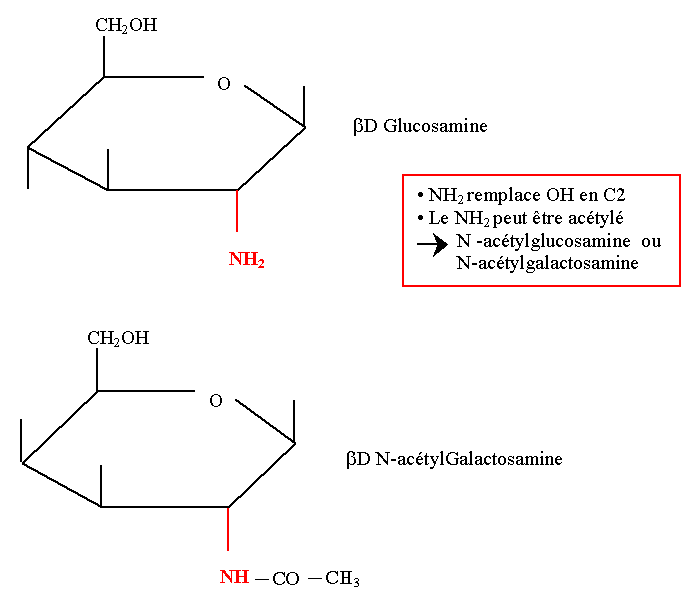
Dérivés amines d’oses biologiques
- Deux osamines ont un intérêt biologique : la Glucosamine et la Galactosamine [-OH en 2 remplacé par -NH2]
- Le -NH2 est souvent acétylé pour donner une N-acétylglucosamine ou une N-acétylgalactosamine
- Les osamines sont des constituants des glycolipides, des glycosaminoglycanes et des glycoprotéines.
- Intérêt biologique des osamines
Dérivés acides d’oses biologiques
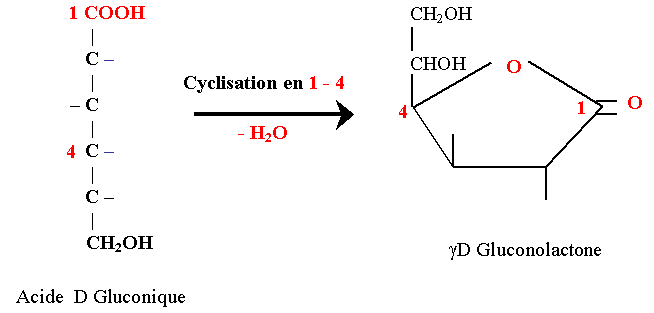
Acides aldoniques
On les obtient par oxydation de la fonction hémiacétalique des aldoses par les halogènes (les cétoses ne réagissent pas).
Acides uroniques
- On les obtient par oxydation de la fonction alcool primaire sur le C6.
- Ce sont des constituants des Glycosaminoglycanes
- Leur rôle biologique est essentiel dans la détoxification hépatique.
Acide sialique (Acide N-acétylneuraminique (NANA))
- L’acide neuraminique est le produit de condensation de : Acide pyruvique + D mannosamine.
- Ce sont des constituants des glycoprotéines et glycolipides de la paroi des cellules eucaryotes.
- L’acide sialique est l’acide N-acétylneuraminique (NANA).
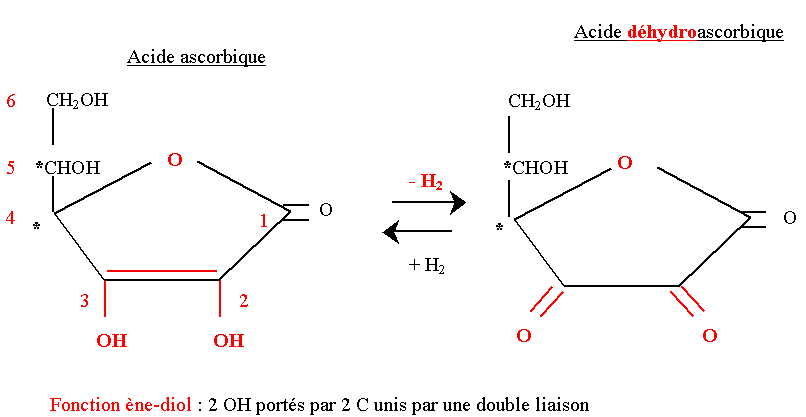
Acide ascorbique (vitamine C)
- Les vitamines ne sont pas synthétisées par l’organisme et sont nécessaires en faible quantité.
- La vitamine C est indispensable car elle n’est pas synthétisée par l’organisme chez l’homme. Sa carence conduit au scorbut.
- C’est une vitamine hydrosoluble. Seule la forme L est active
- C’est un monoacide car elle a un seul H mobile. Sa fonction ène-diol est caractéristique.
- Elle possède un pouvoir très réducteur. Elle est donc facilement oxydable en acide déhydroascorbique qui est aussi biologiquement actif.
- Rôle biologique : c’est le coenzyme de la prolylhydroxylase qui intervient dans la synthèse d’hydroxyproline. Elle intervient aussi dans la synthèse des stéroïdes.
- Sa carence entraîne des anomalies de la synthèse du collagène, la fragilité des parois vasculaires.
Osides
Définition
Les osides sont des molécules qui donnent par hydrolyse 2 ou plusieurs molécules d’oses. Ces oses peuvent être identiques ou différents.
Mode de liaison des oses
Deux oses sont unis entre eux par une liaison osidique (ou glycosidique) pour donner un diholoside. Selon le mode de liaison des 2 oses le diholoside est non réducteur ou réducteur.
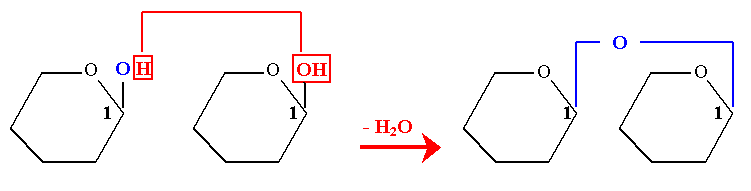
- 1- Diholoside non réducteur : liaison osido-oside
Il y a condensation de la fonction hémiacétalique de chaque ose par une liaison osido-oside
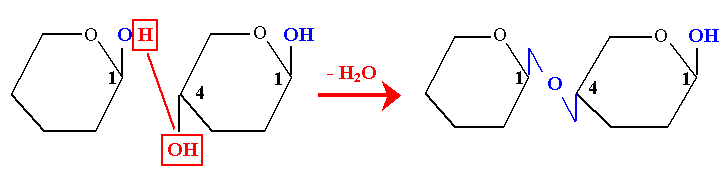
- 2- Diholoside réducteur : liaison osido-ose
Il y a condensation d’une fonction hémiacétalique d’un ose avec une fonction alcoolique d’un second ose par une liaison osido-ose. Il reste donc dans le diholoside un -OH hémiacétalique libre responsable du pouvoir réducteur de la molécule.
- L’association de 2 oses donne un diholoside, de 3 oses donne un triholoside, etc.
Les principaux diholosides
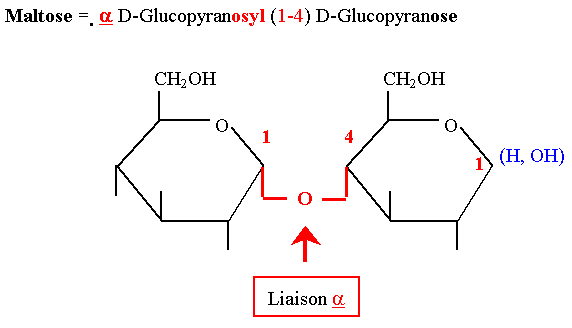
Le Maltose
- C’est un produit d’hydrolyse obtenu lors de la digestion des polyosides (amidon et glycogène) par les amylases.
- Il est formé par l’union de 2 molécules de glucose unies en α 1-4. C’est un oside réducteur.
- Il est hydrolysé en 2 molécules de glucose par une enzyme spécifique, la maltase.
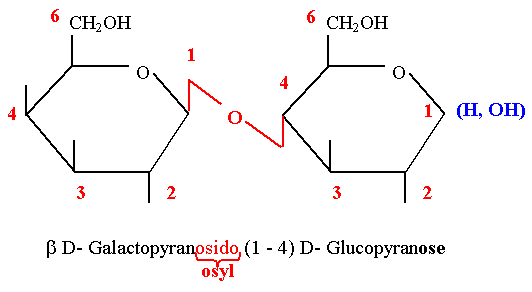
Lactose
- Il est présent dans le lait de tous les mammifères.
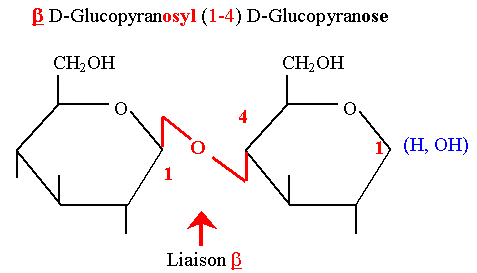
- C’est un diholoside réducteur constitué d’une molécule de Gal et d’une molécule de Glc unies par une liaison β 1-4 osidique.
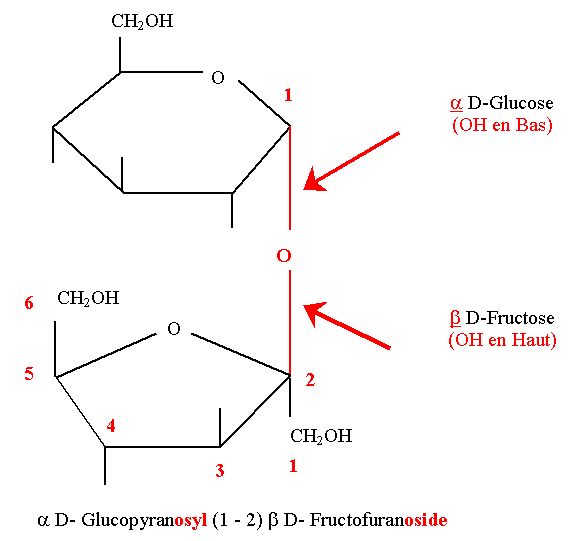
Saccharose
- C’est un diholoside non réducteur, très répandu dans les végétaux. C’est le sucre de table.
Le saccharose a un pouvoir rotatoire dextrogyre. Par hydrolyse il donne naissance à un mélange lévogyre. Ceci s’explique car, dans le mélange, le pouvoir rotatoire lévogyre du fructose (- 92°) est supérieur au pouvoir rotatoire dextrogyre du glucose (+ 52°). Cette propriété a valu au mélange le nom de sucre interverti.
- Le saccharose est hydrolysable par voie enzymatique avec une α glucosidase ou une β fructosidase.
Polyosides
Les polyosides homogènes sont constitués d’un seul type d’ose. Ce sont soit des polyosides de réserve (amidon, glycogène) soit des polyosides de structure (cellulose).
Contrairement aux protéines et aux acides nucléiques, le poids moléculaire des polyosides n’est pas défini car leur programme de synthèse est déterminé par les enzymes.
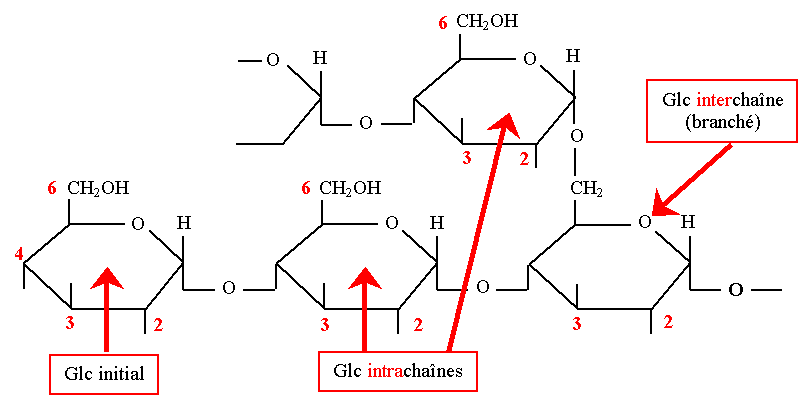
Amidon
- C’est le polyoside végétal le plus abondant (réserve glucidique), qui a un rôle nutritionnel important chez l’homme et l’animal.
- Il est synthétisé dans les grains d’amyloplastes des cellules végétales.
- Son poids moléculaire est variable selon l’espèce végétale et peut atteindre plusieurs millions.
- Il est constitué d’une chaîne principale faite de glucoses unis en α1-4 et de ramifications (ou branchements) faites de glucoses unis en α1-6.
Glycogène
- C’est la forme de stockage du glucose dans le foie et les muscles
- C’est un polyhoside plus ramifié que l’amidon car ses branchements sont plus nombreux (liaisons α1-6) et plus rapprochés.
Cellulose
- C’est un polyoside linéaire qui représente 50 % du carbone végétal.
- Il est formé de l’union de 2 Glucoses unis en β 1-4 (cellobiose).
- Il est hydrolysé par une β glucosidase (cellulase) non présente dans le tube digestif chez l’homme. La cellulose n’est donc pas hydrolysée lors de la digestion chez l’homme.
 Motif de structure de la Cellulose
Motif de structure de la Cellulose
Hydrolyse enzymatique des osides et polyosides
Cette hydrolyse est réalisée par des osidases qui sont spécifiques :
- de la nature de l’ose
- de la configuration anomérique α ou β de la liaison osidique
- de la dimension des unités attaquées dans le polyoside.
Hydrolyse des polyosides lors de la digestion
L’amidon représente la moitié des glucides apportés par l’alimentation chez l’homme. Sa digestion se fait dans le tube digestif grâce à différents enzymes spécifiques.
- Les α amylases (α1-4 glucosidases).
Elles agissent en n’importe quel point de la chaîne sur les liaisons α1-4 pour donner des molécules de maltose et des dextrines limites car leur action s’arrête au voisinage des liaisons α1-6. Il existe une amylase salivaire, peu active car elle est inactivée par le pH acide de l’estomac et, surtout, une amylase pancréatique très active.
- L’enzyme débranchant ou α1-6 glucosidase
Il scinde la liaison α1-6 glucosidique c’est-à-dire les points de branchement. Il est présent dans la bordure en brosse de l’intestin.
- La maltase
Tous les maltoses obtenus précédemment sont hydrolysés en 2 molécules de glucose par la maltase (α1-4 glucosidase).
Hydrolyse des diholosides
- La β fructosidase (saccharase ou invertine) hydrolyse le saccharose :
- Saccharose => Glucose + Fructose
- La β galactosidase (lactase intestinale du nourrisson) hydrolyse le lactose :
- Lactose => Glucose + Galactose
- La β glucosidase, absente chez l’homme, hydrolyse la cellulose.
- La maltase est une α1-4 glucosidase spécifique qui hydrolyse le maltose en 2 molécules de glucose.
Glycosaminoglycanes
Ce sont des polyosides hétérogènes qui résultent de la polycondensation d’osamines et d’acides glucuroniques.
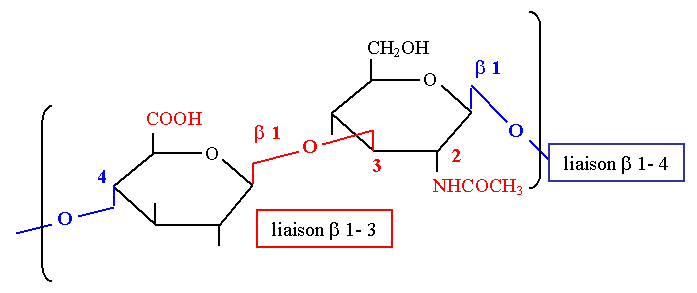
Acide hyaluronique
- Il représente une barrière pour les substances étrangères. Il est présent dans l’humeur vitrée et dans les articulations où il a un rôle de lubrifiant.
- C’est le plus simple des glycosaminoglycanes. Il est constitué de motifs disaccharidiques répétés n fois :
[Acide β D glucuronique + N-acétyl D glucosamine]n
- Les liaisons sont :
- β 1-3 dans le motif
- β 1-4 entre les motifs
- L’acide hyaluronique a un poids moléculaire très élevé et de très nombreuses charges négatives. Il n’y a pas de sulfates.
- Il est hydrolysé par une enzyme de dépolymérisation, la hyaluronidase qui agit entre les chaînons, sur les liaisons β 1-4. Cette enzyme se retrouve dans les bactéries, le venin de serpent, le sperme où elle facilite la pénétration du spermatozoïde dans l’ovule lors de la fécondation en hydrolysant l’enveloppe de l’ovule.
chondroïtines sulfates
On les trouve dans le tissu conjonctif et le cartilage. Elles sont constituées de la polycondensation de motifs disaccharidiques :
[Acide β D glucuronique + N-acétyl galactosamine]n
- Les liaisons sont également β 1-3 dans les motifs et β 1-4 entre les motifs.
- Elles sont très riches en charges négatives en raison des groupements sulfates et uronates. Elles fixent donc fortement les cations. Les sulfates sont fixés en C4 ou C6 de la galactosamine.
Héparine
- C’est un anticoagulant physiologique qui est présent dans de nombreux tissus (foie, poumon, reins, cœur).
Elle est constituée de la polycondensation de :
[Acide α D glucuronique + D Glucosamine N-Sulfate]n
- Les liaisons sont α 1-4 dans le motif et entre les motifs.
Les sulfates sont indispensables à l’activité biologique, ils sont fixés sur l’azote et l’alcool primaire en 6 de la glucosamine mais certaines héparines peuvent en contenir beaucoup plus.
Glycoprotéines
Définition
Ce sont des hétéroprotéines qui résultent de l’union d’une fraction glucidique (de type oligoside) et protéique par des liaisons covalentes. Elles sont très répandues dans la nature et ont des fonctions biologiques très variées. Elles renferment plus de 5 % de glucides.
Fraction glucidique
On trouve 4 groupes de glucides :
- Oses : D mannose D galactose
- 6-désoxyhexoses : L fucose (6 désoxy L galactose)
- Glucosamine et galactosamine souvent acétylées
- Acide N-acétylneuraminique (NANA) souvent terminal qui donne leur caractère acide aux glycoprotéines.
- Enchaînement glucidique souvent ramifié, caractéristique (glycosyl-transférases spécifiques).
Liaison des fractions glucidiques et protéiques
La liaison se fait entre le groupement réducteur terminal de la fraction glucidique et un acide aminé de la protéine au niveau :
- d’une fonction alcool d’un acide aminé alcool (sérine, thréonine) = liaison O-Glycosidique
- d’une fonction amide de la glutamine ou de l’asparagine : liaison N-glycosidique
- la liaison se fait sur un motif spécifique, dans un environnement approprié de la protéine.
Rôle biologique des fractions glucidiques
- Elles permettent la reconnaissance spécifique par d’autres protéines comme les lectines.
- Elles interviennent dans l’interaction cellule-cellule : contact, transfert d’information, …
- Elles influencent le repliement des protéines.
- Elles protègent les protéines contre les protéases.
- La spécificité des groupes sanguins dépend de la fraction glucidique des glycoprotéines des globules rouges.
Les principales glycoprotéines
- Les hormones hypophysaires : LH et FSH.
- Les glycoprotéines du plasma : Orosomucoïdes, haptoglobine.
- Les glycoprotéines du blanc d’œuf : ovalbumine.
- Les glycoprotéines végétales ou lectines, sont des réactifs utilisés pour leurs propriétés d’agglutination des globules rouges, leurs propriétés mitogènes, etc.