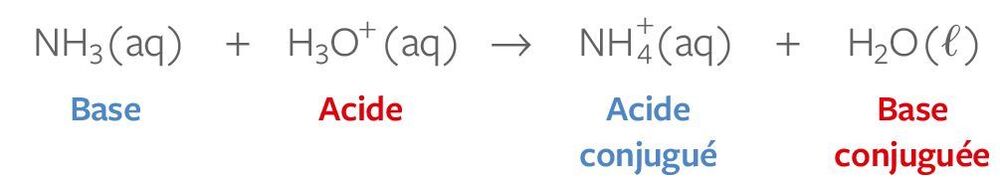Différences entre versions de « Acides et Bases »
De Didaquest
Aller à la navigationAller à la recherche| Ligne 12 : | Ligne 12 : | ||
[[{{FULLPAGENAME}}]] (Français) | [[{{FULLPAGENAME}}]] (Français) | ||
| − | / [[ | + | / [[acid-base]] (Anglais) |
| − | / [[ | + | / [[المحاليل القلوية والشاردية]] (Arabe) |
}}<!-- ************** Fin Fiche Didactique Traduction ********************* --> | }}<!-- ************** Fin Fiche Didactique Traduction ********************* --> | ||
Version du 7 février 2023 à 00:19
 Traduction
Traduction
 Définition
Définition
Domaine, Discipline, Thématique
Définition écrite
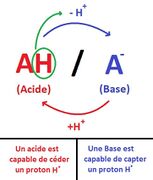
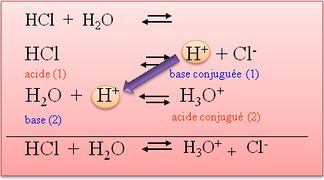
- Un acide est une substance chimique qui a une teneur élevée en ions hydronium (H3O+) en solution. Les acides peuvent réagir avec les bases pour former des sels et de l'eau. Les acides sont souvent décrits comme ayant un goût aigre et une réaction avec des métaux pour produire des gaz comme le dioxyde de carbone ou de l'hydrogène.
- Une base est une substance chimique différente d'un acide. Les bases ont une teneur élevée en ions hydroxyle (OH-) en solution et peuvent réagir avec les acides pour former des sels et de l'eau. Les bases sont souvent décrites comme ayant un goût alcalin et une réaction avec les acides pour produire une solution tamponée, ce qui signifie que le pH de la solution reste relativement stable.
|
Définition graphique
 Concepts ou notions associés
Concepts ou notions associés
 Exemples, applications, utilisations
Exemples, applications, utilisations
................................................................................ ................................................................................ ................................................................................
................................................................................ ................................................................................ ................................................................................ |
 Erreurs ou confusions éventuelles
Erreurs ou confusions éventuelles
- .........................................
- .........................................
![]() Confusion possible ou glissement de sens
Confusion possible ou glissement de sens
- Confusion entre ....... - ........
- Confusion entre ....... - ........
- ....................
 Questions possibles
Questions possibles
 Liaisons enseignements et programmes
Liaisons enseignements et programmes
Idées ou Réflexions liées à son enseignement
Aides et astuces
Education: Autres liens, sites ou portails
 Bibliographie
Bibliographie
Pour citer cette page: (et Bases)
ABROUGUI, M & al, 2023. Acides et Bases. In Didaquest [en ligne]. <http:www.didaquest.org/wiki/Acides_et_Bases>, consulté le 11, mai, 2024
- ..................
- ..................
- ..................
- ..................