Différences entre versions de « Quels sont les acides forts ? »
(Page créée avec « {{Widget:Fiche-Questions-Haut}} = {{Widget:Questions-possibles-Fiche}} = <!-- ********** Début Fiche Didactique Questions ******************--> {{Fiche Didactique Quest... ») |
|||
| (6 versions intermédiaires par le même utilisateur non affichées) | |||
| Ligne 10 : | Ligne 10 : | ||
* [[{{FULLPAGENAME}}]] | * [[{{FULLPAGENAME}}]] | ||
| − | * [[ | + | * [[définir un acide fort .]] |
| − | * [[ | + | * [[c'est quoi un acide fort ?]] |
* [[.................. ?]] | * [[.................. ?]] | ||
* [[.................. ?]] | * [[.................. ?]] | ||
| Ligne 27 : | Ligne 27 : | ||
<!-- ****************** Commercez les modifications *********************** --> | <!-- ****************** Commercez les modifications *********************** --> | ||
| − | + | Un acide fort est un acide qui, en solution aqueuse, se dissocie totalement en ions H+ et une base très faible dite base conjuguée de l'acide. | |
| − | + | Les acides forts sont principalement utilisés pour : les dosages acide-base ; les hydrolyses. | |
| − | .. | + | |
| − | + | Parmi les acides forts, on trouve : | |
| − | * | + | l'acide chlorhydrique, solution aqueuse du chlorure d'hydrogène HCl ; l'acide sulfurique H2SO4 ; l'acide nitrique HNO3 ; l'acide iodhydrique, solution aqueuse de l'iodure d'hydrogène HI ; l'acide bromhydrique, solution aqueuse du bromure d'hydrogène HBr ; l'acide perchlorique HClO4 ; l'acide chlorique HClO3 ; l'acide permanganique HMnO4 ; l'acide manganique H2MnO4. |
| − | + | ||
| − | . | + | |
| − | + | >Sécurité Les acides forts sont des produits à manipuler avec précautions. Des règles de sécurité sont à respecter lors de leurs utilisations. Les mentions de danger prévues par le système général harmonisé SGH et son adaptation européenne (règlement CE no 1272/2008) sont les suivantes : | |
| + | |||
| + | * H314 : provoque de graves brûlures de la peau et des lésions oculaires ; | ||
| + | * H318 : provoque des lésions oculaires graves. | ||
| + | La plupart des acides forts sont corrosifs mais ce n'est pas toujours le cas : le carborane est un superacide un million de fois plus acide que l'acide sulfurique mais il est entièrement non corrosif. Par contre l'acide sulfurique est extrêmement corrosif et provoque de graves brûlures. | ||
| + | |||
}}<!-- ************************* Fin *****************************************--> | }}<!-- ************************* Fin *****************************************--> | ||
| Ligne 46 : | Ligne 51 : | ||
<!----------------- Commencez les modifications des Mots Clés ---------------------> | <!----------------- Commencez les modifications des Mots Clés ---------------------> | ||
| − | |Mot-Clé-1= | + | |Mot-Clé-1=acidité |
| − | |Mot-Clé-2= | + | |Mot-Clé-2=réaction chimique |
| − | |Mot-Clé-3= | + | |Mot-Clé-3=base conjuguée |
| − | |Mot-Clé-4= | + | |Mot-Clé-4=équation chimique |
| − | |Mot-Clé-5= | + | |Mot-Clé-5=pH |
| − | |Mot-Clé-6= | + | |Mot-Clé-6=ampholyte |
| − | |Mot-Clé-7= | + | |Mot-Clé-7=pka |
| − | |Mot-Clé-8= | + | |Mot-Clé-8=couple acide/base |
|Mot-Clé-9= | |Mot-Clé-9= | ||
|Mot-Clé-10= | |Mot-Clé-10= | ||
| Ligne 71 : | Ligne 76 : | ||
<!-- Remplacez, Adaptez, Ajoutez ou Supprimez les images et lignes non utilisées--> | <!-- Remplacez, Adaptez, Ajoutez ou Supprimez les images et lignes non utilisées--> | ||
| − | Image: | + | Image:Acide__fort.jpg|acide fort |
| − | Image: | + | Image:Ph dun acide fort.jpg|pH d'un acide fort |
| − | Image: | + | Image:Ph_de_solution_aqueuse.gif|ph d'une solution aqueuse |
</gallery><!-- ************** Fin modification images***************************--> | </gallery><!-- ************** Fin modification images***************************--> | ||
| Ligne 84 : | Ligne 89 : | ||
<!-- ****************** Commercez les modifications pour les Vidéos *******************************************************--> | <!-- ****************** Commercez les modifications pour les Vidéos *******************************************************--> | ||
| − | <youtube width="250" height="250"> | + | <youtube width="250" height="250">556BUn2S-zM</youtube> |
| − | <youtube width="250" height="250"> | + | <youtube width="250" height="250">7S3XWZGNMlU</youtube> |
| − | + | ||
}}<!-- ************************* Fin modifications pour les Médias *******************************************************--> | }}<!-- ************************* Fin modifications pour les Médias *******************************************************--> | ||
| − | |||
= {{Widget:Bibliographie-Fiche}} = | = {{Widget:Bibliographie-Fiche}} = | ||
Version actuelle datée du 2 janvier 2020 à 20:45
 Questions possibles
Questions possibles
 Eléments de réponse
Eléments de réponse
Un acide fort est un acide qui, en solution aqueuse, se dissocie totalement en ions H+ et une base très faible dite base conjuguée de l'acide. Les acides forts sont principalement utilisés pour : les dosages acide-base ; les hydrolyses.
Parmi les acides forts, on trouve : l'acide chlorhydrique, solution aqueuse du chlorure d'hydrogène HCl ; l'acide sulfurique H2SO4 ; l'acide nitrique HNO3 ; l'acide iodhydrique, solution aqueuse de l'iodure d'hydrogène HI ; l'acide bromhydrique, solution aqueuse du bromure d'hydrogène HBr ; l'acide perchlorique HClO4 ; l'acide chlorique HClO3 ; l'acide permanganique HMnO4 ; l'acide manganique H2MnO4.
>Sécurité Les acides forts sont des produits à manipuler avec précautions. Des règles de sécurité sont à respecter lors de leurs utilisations. Les mentions de danger prévues par le système général harmonisé SGH et son adaptation européenne (règlement CE no 1272/2008) sont les suivantes :
- H314 : provoque de graves brûlures de la peau et des lésions oculaires ;
- H318 : provoque des lésions oculaires graves.
La plupart des acides forts sont corrosifs mais ce n'est pas toujours le cas : le carborane est un superacide un million de fois plus acide que l'acide sulfurique mais il est entièrement non corrosif. Par contre l'acide sulfurique est extrêmement corrosif et provoque de graves brûlures.
 Concepts ou notions associés
Concepts ou notions associés
acidité / réaction chimique / base conjuguée / équation chimique / pH / ampholyte / pka / couple acide/base /
Sur Quora (Questions / Réponses ) : acidité/ réaction chimique / base conjuguée / équation chimique / pH
| Références
| |||
|---|---|---|---|
|
Sur le Portail Questions / Réponses |
Sur Portail de Formation Gratuite |
Sur des sites de Formation |
Sur DidaQuest |
| Quels sont les acides forts ? sur : Wikipedia / Wikiwand / Universalis / Larousse encyclopédie | |||
| Sur Wikiwand : acidité - Wikiwand / réaction chimique - Wikiwand / base conjuguée - Wikiwand / équation chimique - Wikiwand / pH - Wikiwand | |||
| Sur Wikipédia : acidité - Wikipedia / réaction chimique - Wikipedia / base conjuguée - Wikipedia / équation chimique - Wikipedia / pH - Wikipedia | |||
| Sur Wikiversity : acidité - Wikiversity / réaction chimique - Wikiversity / base conjuguée - Wikiversity / équation chimique - Wikiversity / pH - Wikiversity | |||
| Sur Universalis : acidité - Universalis / réaction chimique - Universalis / base conjuguée - Universalis / équation chimique - Universalis / pH - Universalis | |||
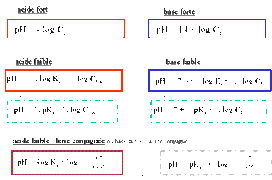
 Réponse graphique
Réponse graphique
 Bibliographie
Bibliographie
Pour citer cette page: (sont les acides forts ?)
ABROUGUI, M & al, 2020. Quels sont les acides forts ?. In Didaquest [en ligne]. <http:www.didaquest.org/wiki/Quels_sont_les_acides_forts_%3F>, consulté le 18, mai, 2024
- ..................
- ..................
- ..................
- ..................