Différences entre versions de « Réaction acido basique »
| Ligne 69 : | Ligne 69 : | ||
° acide méthanoïque (formique) / ion méthanoate (ion formiate) : HCOOH / HCOO– | ° acide méthanoïque (formique) / ion méthanoate (ion formiate) : HCOOH / HCOO– | ||
° acide éthanoïque (acétique) / ion éthanoate (ion acétate) : CH3COOH(aq) / CH3COO–(aq) | ° acide éthanoïque (acétique) / ion éthanoate (ion acétate) : CH3COOH(aq) / CH3COO–(aq) | ||
| + | |||
| + | *On appelle acide au sens de Brønsted toute espèce chimique capable de céder un ou plusieurs protons H+. Par exemple, l'acide acétique ou éthanoïque de formule chimique CH3CO2H est capable de céder un proton H+. Il s'agit donc d'un acide au sens de Brønsted. | ||
| + | |||
| + | On appelle base au sens de Brønsted toute espèce chimique capable de capter un ou plusieurs protons H+. Par exemple, l'ion acétate CH3CO2– est capable de capter un proton H+ pour donner l'acide éthanoïque. Il s'agit donc d'une base au sens de Brønsted. | ||
| + | |||
| + | Dans ce cadre théorique, le potentiel hydrogène ou pH est la valeur négative du logarithme décimal de la concentration en ions hydronium noté H+ ou mieux H3O+, cette concentration étant exprimée en moles par litre. | ||
| + | |||
| + | {\displaystyle \mathrm {pH} =-\log _{10}{\frac {\left[\mathrm {H_{3}O^{+}} \right]}{C^{0}}}}{\displaystyle \mathrm {pH} =-\log _{10}{\frac {\left[\mathrm {H_{3}O^{+}} \right]}{C^{0}}}} | ||
| + | Dans le cadre de cette théorie, les acides sont reconnaissables en solution aqueuse par un pH inférieur à 7 et les bases par un pH supérieur à 7. Si la concentration est très forte, avoisinant par le bas une mole par litre, le pH qui tend vers 0 n'a plus de sens physique. | ||
| + | |||
| + | Les acides et les bases peuvent être regroupés en couples acide/base. En effet, un acide perdant un proton H+ produit une espèce capable d'en capter un appelée base conjuguée. | ||
| + | |||
| + | Exemples | ||
| + | CH3CO2H/CH3CO2– | ||
| + | NH4+/NH3 | ||
| + | C2H5CO2H/C2H5CO2– | ||
| + | La réaction Acide = Base + H+ est une réaction équilibrée dont la constante d'équilibre Ka est notée fréquemment sous la forme logarithmique négative (–log10(Ka)= pKa). Plus le pKa est élevé, plus l'acide est faible. Un acide fort est un acide dont le pKa est négatif. | ||
| + | |||
| + | Parfois, suivant les réactions, certains corps peuvent se comporter comme des acides ou des bases. Ces corps sont des ampholytes. On dit aussi qu'ils ont un caractère amphotère. L'eau par exemple est un ampholyte. En effet, deux couples acide/base sont possibles : | ||
| + | |||
| + | H2O/HO– (pKa = 15,74 à 25 °C1) | ||
| + | H3O+/H2O (pKa = –1,74 à 25 °C1) | ||
| + | L'acidité ou la basicité d'un ampholyte se définit par le réactif avec lequel on l'associe. En effet, l'eau est une base en présence d'un acide puisqu'un acide doit forcément réagir avec une base (sa base conjuguée). À l'inverse, si l'eau est en présence d'une base elle agit comme un acide puisqu'une base doit obligatoirement réagir avec un acide. | ||
| + | |||
| + | *Un acide de Lewis est caractérisé par : | ||
| + | une fraction de charge positive sur l'atome central (due à la forte électronégativité des atomes liés à ce centre) ; | ||
| + | la capacité d'accepter une paire d'électron supplémentaire. | ||
| + | Exemples : H+, AlH3. | ||
| + | Une base est toute espèce qui possède une paire d'électrons non-liante et qui peut offrir une paire d'électrons à une autre espèce chimique lors d'une réaction. Une base de Lewis est donc un donneur d'électrons (nucléophile). | ||
| + | Exemples : NH3 (une paire non-liante), HO– (une paire non-liante). | ||
| + | BF3 est un acide de Lewis, le bore porte une charge partielle positive à cause de la très grande électronégativité des atomes de fluor qui captent vers eux les électrons du bore ; NH3 est une base, car l'atome d'azote porte une paire d'électrons non-liants. | ||
| + | |||
| + | Remarques | ||
| + | |||
| + | Un solvant protique peut fournir et/ou capter un ion H+. Il joue alors le rôle de l'acide et/ou de la base. L'eau, l'ammoniac, le méthanol, l'acide éthanoïque, l'acide sulfurique, etc., ont ce statut de solvant protique accepteur et donneur de proton. Pour chacun d'entre eux, il existe l'équivalent du produit ionique de l'eau. | ||
| + | Un solvant tel un éther-oxyde (R-O-R) peut capter un proton mais ne peut pas en donner. Un tel solvant ne possède qu'un unique Ka. Il n'existe donc pas l'équivalent du produit ionique de l'eau. | ||
| + | Un solvant tel le benzène et le pentane ne peut donner ni accepter de proton. Il n'a donc aucune relation de nature acide-base avec ses solutés. | ||
| + | L'eau et les solvants protiques agissent soit comme base soit comme acide, parce qu'ils ont des sites acides et basiques dans leur structure moléculaire. L'eau peut agir : | ||
| + | comme base en engageant une paire d'électrons libres de l'atome d'oxygène ; | ||
| + | comme acide en cédant un de ses atomes d'hydrogène sous forme d'ion H+. | ||
| + | Le modèle des acides et des bases proposé par Brønsted s'apparente à celui proposé par Lewis. Le modèle des acides et des bases de Lewis considère l'interaction d'un électrophile (ex. : ion Cu2+) et d'un nucléophile (ex. : NH3) pour donner un complexe. L'interaction acide-base au sens de Brønsted peut être considérée comme un cas particulier de l'interaction électrophile-nucléophile du modèle de Lewis où l'ion H+ est l'électrophile et la base de Brønsted est le nucléophile. Il faut noter que les termes électrophile et nucléophile ont quelques différences avec leur utilisation comme centre électrophile et centre nucléophile en chimie organique. | ||
| + | Dans la réaction acide-base au sens de Brønsted, une base ne peut réagir avec un ion H+ qu'en établissant une liaison covalente avec cet ion dépourvu d'électrons, et doit donc fournir le doublet liant de la liaison covalente. | ||
<!-- ******** Fin Définition Générale ***************************** --> | <!-- ******** Fin Définition Générale ***************************** --> | ||
Version du 2 décembre 2019 à 17:01
 Traduction
Traduction
Réaction acido basique (Français)
/ Acid–base reaction (Anglais)
/ التفاعل الحمضي-القاعدي (Arabe)
 Définition
Définition
Domaine, Discipline, Thématique
Définition écrite
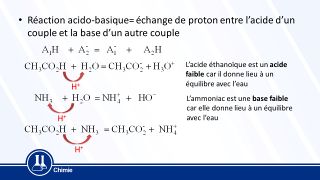
- Une réaction acido-basique met en jeu deux couples acide-base : le couple Acide1/Base1 et le couple Acide2/Base2.
Une réaction acide-base est une transformation chimique entre l'acide d'un couple et la base d'un autre couple acide/base, par l'intermédiaire d'un échange d'ions H+. Pour équilibrer l'équation de la réaction qui a lieu entre les deux couples, on établit les demi-équations associées à chaque espèce chimique, puis on les additionne de façon à ne plus avoir de proton H+ (c'est-à-dire obtenir autant d'ions du côté des réactifs et des produits).
L'équation complète est donc une combinaison linéaire des deux demi-équations spécifiques de chaque couple :
Acide1 = Base1 + nH+ Base2 + nH+ = Acide2 Acide1 + Base2 = Base1 + Acide2 (cette équation est dite une « équation-bilan ».)
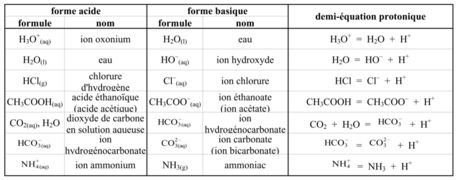
- Tous les couples acide-base s'écrivent sous la forme acide/base:
° ion hydronium / eau : H3O+ / H2O ° eau / ion hydroxyde : H2O / HO– ° acide éthanedioïque (acide oxalique) / ion hydrogénoxalate : C2O4H2 / HC2O4– ° ion hydrogénoxalate / ion éthanedioate : HC2O4– / C2O42– ° ion méthylammonium / méthylamine : CH3NH3+ / CH3NH2 ° ion ammonium / ammoniac : NH4+ / NH3 ° acide méthanoïque (formique) / ion méthanoate (ion formiate) : HCOOH / HCOO– ° acide éthanoïque (acétique) / ion éthanoate (ion acétate) : CH3COOH(aq) / CH3COO–(aq)
- On appelle acide au sens de Brønsted toute espèce chimique capable de céder un ou plusieurs protons H+. Par exemple, l'acide acétique ou éthanoïque de formule chimique CH3CO2H est capable de céder un proton H+. Il s'agit donc d'un acide au sens de Brønsted.
On appelle base au sens de Brønsted toute espèce chimique capable de capter un ou plusieurs protons H+. Par exemple, l'ion acétate CH3CO2– est capable de capter un proton H+ pour donner l'acide éthanoïque. Il s'agit donc d'une base au sens de Brønsted.
Dans ce cadre théorique, le potentiel hydrogène ou pH est la valeur négative du logarithme décimal de la concentration en ions hydronium noté H+ ou mieux H3O+, cette concentration étant exprimée en moles par litre.
{\displaystyle \mathrm {pH} =-\log _{10}{\frac {\left[\mathrm {H_{3}O^{+
|
{{{Typologie}}} |
\right]}{C^{0}}}}{\displaystyle \mathrm {pH} =-\log _{10}{\frac {\left[\mathrm {H_{3}O^{+}} \right]}{C^{0}}}}
Dans le cadre de cette théorie, les acides sont reconnaissables en solution aqueuse par un pH inférieur à 7 et les bases par un pH supérieur à 7. Si la concentration est très forte, avoisinant par le bas une mole par litre, le pH qui tend vers 0 n'a plus de sens physique.
Les acides et les bases peuvent être regroupés en couples acide/base. En effet, un acide perdant un proton H+ produit une espèce capable d'en capter un appelée base conjuguée.
Exemples CH3CO2H/CH3CO2– NH4+/NH3 C2H5CO2H/C2H5CO2– La réaction Acide = Base + H+ est une réaction équilibrée dont la constante d'équilibre Ka est notée fréquemment sous la forme logarithmique négative (–log10(Ka)= pKa). Plus le pKa est élevé, plus l'acide est faible. Un acide fort est un acide dont le pKa est négatif.
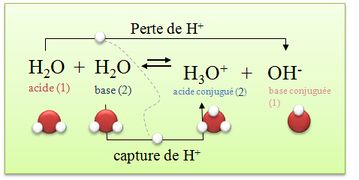
Parfois, suivant les réactions, certains corps peuvent se comporter comme des acides ou des bases. Ces corps sont des ampholytes. On dit aussi qu'ils ont un caractère amphotère. L'eau par exemple est un ampholyte. En effet, deux couples acide/base sont possibles :
H2O/HO– (pKa = 15,74 à 25 °C1) H3O+/H2O (pKa = –1,74 à 25 °C1) L'acidité ou la basicité d'un ampholyte se définit par le réactif avec lequel on l'associe. En effet, l'eau est une base en présence d'un acide puisqu'un acide doit forcément réagir avec une base (sa base conjuguée). À l'inverse, si l'eau est en présence d'une base elle agit comme un acide puisqu'une base doit obligatoirement réagir avec un acide.
- Un acide de Lewis est caractérisé par :
une fraction de charge positive sur l'atome central (due à la forte électronégativité des atomes liés à ce centre) ; la capacité d'accepter une paire d'électron supplémentaire. Exemples : H+, AlH3. Une base est toute espèce qui possède une paire d'électrons non-liante et qui peut offrir une paire d'électrons à une autre espèce chimique lors d'une réaction. Une base de Lewis est donc un donneur d'électrons (nucléophile). Exemples : NH3 (une paire non-liante), HO– (une paire non-liante). BF3 est un acide de Lewis, le bore porte une charge partielle positive à cause de la très grande électronégativité des atomes de fluor qui captent vers eux les électrons du bore ; NH3 est une base, car l'atome d'azote porte une paire d'électrons non-liants.
Remarques
Un solvant protique peut fournir et/ou capter un ion H+. Il joue alors le rôle de l'acide et/ou de la base. L'eau, l'ammoniac, le méthanol, l'acide éthanoïque, l'acide sulfurique, etc., ont ce statut de solvant protique accepteur et donneur de proton. Pour chacun d'entre eux, il existe l'équivalent du produit ionique de l'eau. Un solvant tel un éther-oxyde (R-O-R) peut capter un proton mais ne peut pas en donner. Un tel solvant ne possède qu'un unique Ka. Il n'existe donc pas l'équivalent du produit ionique de l'eau. Un solvant tel le benzène et le pentane ne peut donner ni accepter de proton. Il n'a donc aucune relation de nature acide-base avec ses solutés. L'eau et les solvants protiques agissent soit comme base soit comme acide, parce qu'ils ont des sites acides et basiques dans leur structure moléculaire. L'eau peut agir : comme base en engageant une paire d'électrons libres de l'atome d'oxygène ; comme acide en cédant un de ses atomes d'hydrogène sous forme d'ion H+. Le modèle des acides et des bases proposé par Brønsted s'apparente à celui proposé par Lewis. Le modèle des acides et des bases de Lewis considère l'interaction d'un électrophile (ex. : ion Cu2+) et d'un nucléophile (ex. : NH3) pour donner un complexe. L'interaction acide-base au sens de Brønsted peut être considérée comme un cas particulier de l'interaction électrophile-nucléophile du modèle de Lewis où l'ion H+ est l'électrophile et la base de Brønsted est le nucléophile. Il faut noter que les termes électrophile et nucléophile ont quelques différences avec leur utilisation comme centre électrophile et centre nucléophile en chimie organique. Dans la réaction acide-base au sens de Brønsted, une base ne peut réagir avec un ion H+ qu'en établissant une liaison covalente avec cet ion dépourvu d'électrons, et doit donc fournir le doublet liant de la liaison covalente.
|Typologie=
- ......................................................................
....................................................................... ....................................................................... .......................................................................
- ......................................................................
....................................................................... ....................................................................... }}
Définition graphique
 Concepts ou notions associés
Concepts ou notions associés
 Exemples, applications, utilisations
Exemples, applications, utilisations
Demi-équation du couple A1/B1 : CH3COOH(aq) = CH3COO−(aq) + H+ Demi-équation du couple A2/B2 (inversée) : HO−(aq) + H+ = H2O(l) Équation de la réaction acido-basique : CH3COOH(aq) + HO−(aq) → CH3COO−(aq) + H2O(l)
................................................................................ ................................................................................ ................................................................................ |
 Erreurs ou confusions éventuelles
Erreurs ou confusions éventuelles
- Confusion entre acide et base
- Confusion entre acide fort et acide faibe
- Confusion entre équation bilan et base demi-équation
- Erreur fréquente: ....................
 Questions possibles
Questions possibles
- [[ On prépare une solution en mettant une masse m=0,32g de chlorure d'ammonium dans un volume V=100mL d'eau sans variation de volume. Le pH de la solution obtenue est pH=5,2.
1. Donner l'équation de dissolution du chlorure d'ammonium.
2. Montrer que l'ion ammonium est un acide faible.
3. Donner l'équation de la réaction entre l'ion ammonium et l'eau. ]]
 Liaisons enseignements et programmes
Liaisons enseignements et programmes
Idées ou Réflexions liées à son enseignement
Aides et astuces
- Le couple Acide/Base est de la forme :
AH / A−
La demi-équation Acide/Base correspondante est :
AH <=> A− + H+
- Une espèce à la fois base conjuguée d'un couple et acide conjugué d'un autre est appelée ampholyte ou amphotère : elle peut réagir comme une base ou comme un acide.
exemple :
* H3O+/ H2O(l) : dans ce couple l’eau est une base H3O+ = H2O(l) + H+
*H2O / HO-(aq) : dans ce couple l’eau est un acide H2O = HO-(aq) + H+
=> L'eau peut être un acide ou une base. On dit que l’eau est un ampholyte ou une espèce amphotère.
- .................
Education: Autres liens, sites ou portails
 Bibliographie
Bibliographie
Pour citer cette page: (acido basique)
ABROUGUI, M & al, 2019. Réaction acido basique. In Didaquest [en ligne]. <http:www.didaquest.org/wiki/R%C3%A9action_acido_basique>, consulté le 16, février, 2025
- ..................
- ..................
- ..................
- ..................