Différences entre versions de « Réaction acido basique »
| (7 versions intermédiaires par le même utilisateur non affichées) | |||
| Ligne 153 : | Ligne 153 : | ||
Image:14820.gif|reaction aside base | Image:14820.gif|reaction aside base | ||
Image:Réaction_(acide-base)_acide_carbox-alcoolate.gif|Réaction entre l'acide carboxique et l'ion alcoolate | Image:Réaction_(acide-base)_acide_carbox-alcoolate.gif|Réaction entre l'acide carboxique et l'ion alcoolate | ||
| + | |||
</gallery><!-- ************** Fin modification images***************************--> | </gallery><!-- ************** Fin modification images***************************--> | ||
| Ligne 162 : | Ligne 163 : | ||
<!--Ajoutez ou supprimez les lignes non utilisées ---------------------------------------------------------------------------> | <!--Ajoutez ou supprimez les lignes non utilisées ---------------------------------------------------------------------------> | ||
<!-- ****************** Commercez les modifications pour les Vidéos *******************************************************--> | <!-- ****************** Commercez les modifications pour les Vidéos *******************************************************--> | ||
| + | |||
| + | '''*Les acides et les bases*''' | ||
| + | |||
| + | <youtube width="220" height="220">jyZoCaDKV7k</youtube> | ||
| + | |||
| + | |||
| + | '''*La réaction acido-basique (selon la théorie de brönstedt )*''' | ||
<youtube width="220" height="220">gicX8K7Aiuo</youtube> | <youtube width="220" height="220">gicX8K7Aiuo</youtube> | ||
| − | <youtube width="220" height="220"> | + | |
| − | <youtube width="220" height="220"> | + | |
| − | + | '''*Calculer le pH d'une base faible & d'un acide faible*''' | |
| + | |||
| + | <youtube width="220" height="220">556BUn2S-zM</youtube> | ||
| + | |||
| + | |||
| + | '''*Calculer le pH d'une base forte & d'un acide fort*''' | ||
| + | |||
| + | <youtube width="220" height="220">hiyaXlT-YBY</youtube> | ||
| + | |||
| + | |||
| + | |||
}}<!-- ************************* Fin modifications pour les Médias *******************************************************--> | }}<!-- ************************* Fin modifications pour les Médias *******************************************************--> | ||
| Ligne 235 : | Ligne 253 : | ||
* Confusion entre [[acide et base]] | * Confusion entre [[acide et base]] | ||
* Confusion entre [[acide fort et acide faibe]] | * Confusion entre [[acide fort et acide faibe]] | ||
| − | * Confusion entre [[équation bilan et | + | * Confusion entre [[équation bilan et demi-équation]] |
* Erreur fréquente: ° Conception péjorative des acides sur la santé | * Erreur fréquente: ° Conception péjorative des acides sur la santé | ||
| Ligne 251 : | Ligne 269 : | ||
<!-- ************ Commercez les modifications *********************--> | <!-- ************ Commercez les modifications *********************--> | ||
| − | * | + | * [[Comment justifier qu'une réaction est Acido-basique ? ]] |
| − | + | * [[Qu'est-ce qu'un couple Acido-basique ?]] | |
| − | + | * [[Quel est le pH d'une solution acide ?]] | |
| − | + | * [[C'est quoi une base ?]] | |
| − | + | * [[Quels sont les acides forts ?]] | |
| − | + | * [[Quelle est la base la plus forte ?]] | |
| − | |||
| − | |||
| − | * | ||
| − | * [[ | ||
}}<!-- ******** Fin Fiche Didactique Questions ******************* --> | }}<!-- ******** Fin Fiche Didactique Questions ******************* --> | ||
Version actuelle datée du 2 janvier 2020 à 22:43
 Traduction
Traduction
Réaction acido basique (Français)
/ Acid–base reaction (Anglais)
/ التفاعل الحمضي-القاعدي (Arabe)
/ Asit-baz tepkimesi (Turque)
/ Säure-Base-Reaktion (Allemand)
/ Кислотно-основные реакции (Russe)
 Définition
Définition
Domaine, Discipline, Thématique
Définition écrite
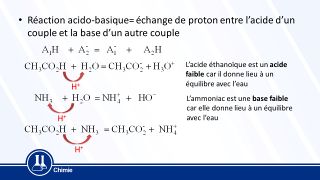
> Une réaction acido-basique est une réaction chimique au cours de laquelle se produit un transfert d'un ou plusieurs ions H+ en solution aqueuse. Une réaction acido-basique met en jeu deux couples acide-base: le couple Acide1/Base1 et le couple Acide2/Base2.
Pour équilibrer l'équation de la réaction qui a lieu entre les deux couples, on établit les demi-équations associées à chaque espèce chimique, puis on les additionne de façon à ne plus avoir de H+, c'est-à-dire obtenir autant d'ions du côté des réactifs que du côté des produits. L'espèce chimique qui capte ces ions est appelée base ; celle qui les cède, acide.
Par convention un couple acide base s'écrit acide/base. Un couple acide base est lié par cet échange de proton H+
La demi-équation acido-basique s'écrit : AH = A- + H+ ou A- + H+ = AH, c'est-à-dire : acide = base + H+ ou base + H+ = acide
Ou plus simplement soit A un acide, B une base et H le proton H+ perdu/gagné : B + AH = A +BH.
On dit aussi que AH est l'acide conjugué de A- ou, A- est la base conjuguée de AH.
Les acides et les bases peuvent être regroupés en couples acide/base. En effet, un acide perdant un proton H+ produit une espèce capable d'en capter un, appelée base conjuguée.
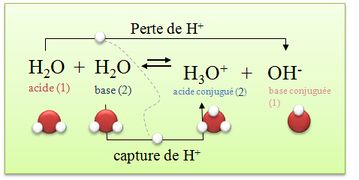
Suivant les réactions, certaines espèces chimiques peuvent se comporter comme des acides ou des bases, elles sont alors appelées ampholytes. Les ampholytes deviennent acide ou basique en fonction du réactif que l'on fait réagir avec. Si ce réactif est un acide, il deviendra basique et inversement. Exemple d'ampholyte : l'eau.
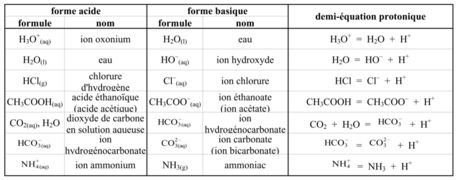
> Tous les couples acide-base s'écrivent sous la forme acide/base; par exemple :
° ion hydronium / eau : H3O+ / H2O ° eau / ion hydroxyde : H2O / HO– ° acide éthanedioïque (acide oxalique) / ion hydrogénoxalate : C2O4H2 / HC2O4– ° ion hydrogénoxalate / ion éthanedioate : HC2O4– / C2O42– ° ion méthylammonium / méthylamine : CH3NH3+ / CH3NH2 ° ion ammonium / ammoniac : NH4+ / NH3 ° acide méthanoïque (formique) / ion méthanoate (ion formiate) : HCOOH / HCOO– ° acide éthanoïque (acétique) / ion éthanoate (ion acétate) : CH3COOH(aq) / CH3COO–(aq)
|
> Différentes théories :
-Théorie d'Arrhénius → Un acide est capable de se dissocier en libérant des ions H+ (protons) en solution aqueuse. En réalité, les protons H+ libres ne sont pas présents en solution, mais se lient à des molécules d'eau pour former des ions oxonium H3O+. → Une base quand à elle est capable de capter un ou plusieurs protons H+ et libérer un ion hydroxyde, OH-.
-Théorie Brønsted-Lowry → Un acide c'est toute espèce chimique capable de céder un ou plusieurs protons H+, c'est-à-dire d'en perdre un . → Par contre une base c'est une espèce chimique capable de capter un ou plusieurs protons H+. Pour cette théorie, les acides sont reconnaissables en solution aqueuse par un pH inférieur à 7 et les bases par un pH supérieur à 7.
-Théorie de Lewis →Un acide est une espèce chimique qui peut capter une paire d'électrons libérée par une autre espèce chimique en solution aqueuse. C'est ce qui le caractérise. C'est un récepteur d'électrons, on dit qu'il est électrophile. →Une base est toute espèce qui possède une paire d'électrons non-liante et qui peut offrir une paire d'électrons à une autre espèce chimique lors d'une réaction. C'est donc un donneur d'électrons, et il est dit nucléophile.
Nucléophile :composé chimique attiré par les espèces chargées positivement
La théorie de Brønsted sur les acides et des bases est très ressemblante à celle de Lewis. Le modèle des acides et des bases de Lewis fait intervenir un électrophile. On peut parler de l'interaction acide-base comme d'un cas particulier de l'interaction électrophile/nucléophile du modèle de Lewis. |
Définition graphique
 Concepts ou notions associés
Concepts ou notions associés
 Exemples, applications, utilisations
Exemples, applications, utilisations
Demi-équation du couple A1/B1 : CH3COOH(aq) = CH3COO−(aq) + H+ Demi-équation du couple A2/B2 (inversée) : HO−(aq) + H+ = H2O(l) Équation de la réaction acido-basique : CH3COOH(aq) + HO−(aq) → CH3COO−(aq) + H2O(l)
................................................................................ ................................................................................ ................................................................................ |
 Erreurs ou confusions éventuelles
Erreurs ou confusions éventuelles
- Confusion entre une réaction chimique et une transformation physique
- Confusion entre acide et base
- Confusion entre acide fort et acide faibe
- Confusion entre équation bilan et demi-équation
- Erreur fréquente: ° Conception péjorative des acides sur la santé
° Les acides sont plus dangereux que les bases
 Questions possibles
Questions possibles
 Liaisons enseignements et programmes
Liaisons enseignements et programmes
Idées ou Réflexions liées à son enseignement
Aides et astuces
- Le couple Acide/Base est de la forme :
AH / A−
La demi-équation Acide/Base correspondante est :
AH <=> A− + H+
- Une espèce à la fois base conjuguée d'un couple et acide conjugué d'un autre est appelée ampholyte ou amphotère : elle peut réagir comme une base ou comme un acide.
exemple :
* H3O+/ H2O(l) : dans ce couple l’eau est une base H3O+ = H2O(l) + H+
*H2O / HO-(aq) : dans ce couple l’eau est un acide H2O = HO-(aq) + H+
=> L'eau peut être un acide ou une base. On dit que l’eau est un ampholyte ou une espèce amphotère.
- Il y a équivalence acido-basique lorsque le nombre de moles d’ions H3O+ fournis par
l’acide est égal au nombre de moles d’ions OH- fournis par la base.
Education: Autres liens, sites ou portails
 Bibliographie
Bibliographie
Pour citer cette page: (acido basique)
ABROUGUI, M & al, 2020. Réaction acido basique. In Didaquest [en ligne]. <http:www.didaquest.org/wiki/R%C3%A9action_acido_basique>, consulté le 25, novembre, 2024
- ..................
- ..................
- ..................
- ..................