Différences entre versions de « Notion de pH »
De Didaquest
Aller à la navigationAller à la recherche| (27 versions intermédiaires par le même utilisateur non affichées) | |||
| Ligne 51 : | Ligne 51 : | ||
<!-- *************** Commercez les modifications *******************--> | <!-- *************** Commercez les modifications *******************--> | ||
| − | *Le pH | + | *Le pH permet de caractériser l’acidité ou la basicité d’une solution. Il est défini par la relation : [H3O+] = 10-pH. |
| − | + | ||
<!-- ******** Fin Définition Générale ***************************** --> | <!-- ******** Fin Définition Générale ***************************** --> | ||
| Ligne 59 : | Ligne 59 : | ||
|Typologie= <!------------------------------------ Ne pas Modifier --> | |Typologie= <!------------------------------------ Ne pas Modifier --> | ||
<!-- ****************** Commercez les modifications ****************--> | <!-- ****************** Commercez les modifications ****************--> | ||
| − | *........ | + | *.Le pH est une grandeur sans unité. Un indice qui permet de mesurer l'activité de l'ion hydrogène dans une solution. L'eau pure contient la même quantité -- même si c'est en proportion très faible -- d'ions hydronium H3O+ et hydroxyde HO- . Elle est neutre. Car pour un milieu donné, le pH est fonction de la concentration en ions hydronium. Il est donné par la relation suivante : pH = -log [H3O+]. Un milieu acide contient donc plus d'ions hydronium que l'eau pure. Un milieu basique en revanche compte plus d'ions hydroxydes que l'eau pure. |
| − | + | *L'abréviation pH renvoie à la notion de potentiel hydrogène. Un concept introduit par le chimiste danois Soren Sorensen en 1893 alors qu'il étudiait la fabrication de la bière. Le pH est depuis devenu un indicateur de l'acidité -- lorsque le pH est inférieur à 7 -- ou de l'alcalinité -- lorsque le pH est supérieur à 7 -- d'une solution. Un milieu neutre affiche un pH égal à 7. C'est le cas de l'eau pure à 25 °C. | |
| − | |||
| − | |||
| − | *.... | ||
| − | |||
| − | |||
}}<!-- ******** Fin Fiche Didactique Définition ******************* --> | }}<!-- ******** Fin Fiche Didactique Définition ******************* --> | ||
| Ligne 81 : | Ligne 76 : | ||
<!-- Remplacez, Adaptez, Ajoutez ou Supprimez les images et lignes non utilisées--> | <!-- Remplacez, Adaptez, Ajoutez ou Supprimez les images et lignes non utilisées--> | ||
Image:NotionpH-HEDDIAhmed001.png|Notion du pH | Image:NotionpH-HEDDIAhmed001.png|Notion du pH | ||
| − | Image: | + | Image:pH-mètre-001.jpg|pH-mètre-001 |
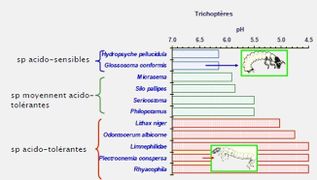
| − | Image: | + | Image:pH-Trichopteres.jpg|pH-Trichopteres |
| + | Image:PH-mètre-Catalogue.pdf|pH-mètre-Catalogue | ||
| + | Image:Cours-2em_Sciences_-notion-de-ph.pdf|Cours-2em_Sciences_-notion-de-ph | ||
| + | Image:ChimieGener-pH.pdf|ChimieGener-pH | ||
</gallery><!-- ************** Fin modification images***************************--> | </gallery><!-- ************** Fin modification images***************************--> | ||
| Ligne 94 : | Ligne 92 : | ||
<youtube width="220" height="220">=dldIraKTrHY</youtube> | <youtube width="220" height="220">=dldIraKTrHY</youtube> | ||
| − | <youtube width="220" height="220"> | + | <youtube width="220" height="220">=BxEXjEGjHRQ</youtube> |
| − | <youtube width="220" height="220"> | + | <youtube width="220" height="220">=U4oKxqVa9Js</youtube> |
}}<!-- ************************* Fin modifications pour les Médias *******************************************************--> | }}<!-- ************************* Fin modifications pour les Médias *******************************************************--> | ||
| Ligne 108 : | Ligne 106 : | ||
<!----------------- Commencez les modifications des Mots Clés ---------------------> | <!----------------- Commencez les modifications des Mots Clés ---------------------> | ||
| − | |Mot-Clé-1= | + | |Mot-Clé-1=chimie |
| − | |Mot-Clé-2= | + | |Mot-Clé-2=acides |
| − | |Mot-Clé-3= | + | |Mot-Clé-3=bases |
| − | |Mot-Clé-4= | + | |Mot-Clé-4=milieu neutre |
| − | |Mot-Clé-5= | + | |Mot-Clé-5=Industrie alimentaire |
| − | |Mot-Clé-6= | + | |Mot-Clé-6=Industrie agroalimentaire |
| − | |Mot-Clé-7= | + | |Mot-Clé-7=Industrie pharmaceutique |
| − | |Mot-Clé-8= | + | |Mot-Clé-8=Industrie cosmétique |
| − | |Mot-Clé-9= | + | |Mot-Clé-9=Industrie de fabrication de détergents et de produits de nettoyage |
|Mot-Clé-10= | |Mot-Clé-10= | ||
}}<!-- ********************* FIN Fiche Didactique Mots-clés *******************--> | }}<!-- ********************* FIN Fiche Didactique Mots-clés *******************--> | ||
| − | |||
= {{Widget:Exemples-applications-utilisations-Fiche}} = | = {{Widget:Exemples-applications-utilisations-Fiche}} = | ||
| Ligne 132 : | Ligne 129 : | ||
<!-- ****************** Commercez les modifications *********************** --> | <!-- ****************** Commercez les modifications *********************** --> | ||
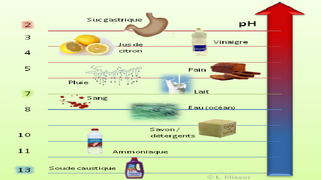
| − | * | + | *Quelques exemples de pH : Jus de citron : pH=2,5 ; Tomates : pH=4,5 ; Eau pure : pH=7 ; Ammoniaque : pH=11 ; Eau de javel : pH=11,5 ; Lessive : pH=13 |
| − | + | ||
| − | + | *La plupart des produits exigent un détail pH pour l'activité ou la stabilité, particulièrement dans l'industrie des produits alimentaires , l'industrie agroalimentaire et des boissons, l'industrie cosmétique et le secteur pharmaceutique. | |
| − | + | ||
| − | * | + | |
| − | + | ||
| − | |||
| − | |||
}}<!--************** Fin Fiche Didactique Explicitations ******************* --> | }}<!--************** Fin Fiche Didactique Explicitations ******************* --> | ||
| − | |||
= {{Widget:Erreurs-confusions-Fiche}} = | = {{Widget:Erreurs-confusions-Fiche}} = | ||
| Ligne 153 : | Ligne 147 : | ||
<!-- ****************** Commercez les modifications *************************--> | <!-- ****************** Commercez les modifications *************************--> | ||
| − | * Confusion entre [[ | + | |
| − | * Confusion entre [[ | + | * Confusion entre [[acide faible et acide fort]] |
| + | * Confusion entre [[base faible et base forte]] | ||
* Erreur fréquente: .................... | * Erreur fréquente: .................... | ||
}}<!-- ************** Fin Fiche Didactique Conceptions ********************* --> | }}<!-- ************** Fin Fiche Didactique Conceptions ********************* --> | ||
| − | |||
= {{Widget:Questions-possibles-Fiche}} = | = {{Widget:Questions-possibles-Fiche}} = | ||
| Ligne 169 : | Ligne 163 : | ||
<!-- ************ Commercez les modifications *********************--> | <!-- ************ Commercez les modifications *********************--> | ||
| − | * [[ | + | * [[le pH?]] |
| − | * [[ | + | * [[étalonnage du pH-mètre?]] |
| − | * [[ | + | * [[échelle du pH ?]] |
}}<!-- ******** Fin Fiche Didactique Questions ******************* --> | }}<!-- ******** Fin Fiche Didactique Questions ******************* --> | ||
| − | |||
= {{Widget:Liens-enseignement-Fiche}} = | = {{Widget:Liens-enseignement-Fiche}} = | ||
| Ligne 220 : | Ligne 213 : | ||
<!-- ****************** Commercez les modifications ************--> | <!-- ****************** Commercez les modifications ************--> | ||
| − | :* ... | + | :* http://www.francaise-bio-energetique.com/equilibre-acido-basique.htm |
| − | :* ... | + | :* https://www.news-medical.net/life-sciences/Importance-of-Measuring-pH-in-Industry-(French).aspx |
| − | :* .... | + | :* https://www.maxicours.com/se/cours/definition-et-mesure-du-ph/ |
| − | + | [[https://phet.colorado.edu/fr/simulation/acid-base-solutions]]simulation swf solutions acido-basiques | |
}}<!-- ************ Fin Liens Education ********************** --> | }}<!-- ************ Fin Liens Education ********************** --> | ||
Version actuelle datée du 3 janvier 2020 à 20:43
 Traduction
Traduction
 Définition
Définition
Domaine, Discipline, Thématique
Définition écrite
- Le pH permet de caractériser l’acidité ou la basicité d’une solution. Il est défini par la relation : [H3O+] = 10-pH.
|
Définition graphique
 Concepts ou notions associés
Concepts ou notions associés
 Exemples, applications, utilisations
Exemples, applications, utilisations
|
 Erreurs ou confusions éventuelles
Erreurs ou confusions éventuelles
- Confusion entre acide faible et acide fort
- Confusion entre base faible et base forte
- Erreur fréquente: ....................
 Questions possibles
Questions possibles
 Liaisons enseignements et programmes
Liaisons enseignements et programmes
Idées ou Réflexions liées à son enseignement
Aides et astuces
Education: Autres liens, sites ou portails
 Bibliographie
Bibliographie
Pour citer cette page: (de pH)
ABROUGUI, M & al, 2020. Notion de pH. In Didaquest [en ligne]. <http:www.didaquest.org/wiki/Notion_de_pH>, consulté le 24, novembre, 2024
- ..................
- ..................
- ..................
- ..................
Catégories :
- Sponsors Education
- Chimie (Concepts)
- Acides (Concepts)
- Bases (Concepts)
- Milieu neutre (Concepts)
- Fruits (Concepts)
- Légumes (Concepts)
- Détergeant (Concepts)
- Chimie
- Acides
- Bases
- Milieu neutre
- Industrie alimentaire
- Industrie agroalimentaire
- Industrie pharmaceutique
- Industrie cosmétique
- Industrie de fabrication de détergents et de produits de nettoyage
- Concepts
- Notion de pH
- Notion de pH (Concepts)
- Fiche conceptuelle didactique