Différences entre versions de « Base faible et base forte »
De Didaquest
Aller à la navigationAller à la recherche| (12 versions intermédiaires par le même utilisateur non affichées) | |||
| Ligne 10 : | Ligne 10 : | ||
{{Conceptions canoniques}} | {{Conceptions canoniques}} | ||
| − | * | + | * La base la plus forte possède la valeur du pH la plus grande |
| + | |||
| + | Pour une base forte : Si Cb représente la concentration de la base alors [OH-]= Cb donc : pH = pKe + log Cb | ||
| + | Pour une base faible : Si Cb représente la concentration de la base alors [OH-] <Cb donc pH < pKe + log Cb | ||
| − | |||
| − | |||
De plus : | De plus : | ||
| − | Pour | + | Pour une base forte : Le coefficient le dissociation a ; a = [OH-]/Cb = 1 |
| − | Pour | + | Pour une base faible : Le coefficient le dissociation a ; a = [OH-]/Cb < 1 d'ou a augmente quand Cb diminue |
On peut conclure : | On peut conclure : | ||
| − | Pour | + | Pour une base forte : La réaction avec l'eau est totale: B + H2O →BH+ + OH- |
| − | Pour | + | Pour une base faible : La réaction avec l'eau n'est pas totale: B + H2O<=>BH+ + OH- |
{{Conceptions erronées}} | {{Conceptions erronées}} | ||
| − | * | + | * la base la plus forte possède la valeur du pH la plus faible |
{{Origines possibles des conceptions}} | {{Origines possibles des conceptions}} | ||
| − | * Si l'individu ne connait pas l'échelle du pH alors ne sais plus le sens de | + | * Si l'individu ne connait pas l'échelle du pH alors ne sais plus le sens de basicité croissante donc ne peut pas faire une comparaison juste de deux acides |
| Ligne 42 : | Ligne 43 : | ||
<!--------- Commencez les modifications Typologie - Conceptions ----------------------> | <!--------- Commencez les modifications Typologie - Conceptions ----------------------> | ||
| − | |Conception-Type-1= | + | |Conception-Type-1= erreur liée aux opérations intellectuelles impliquées |
| − | |Conception-Type-2= | + | |Conception-Type-2= erreur causée par la complexité du contenu |
| − | |Conception-Type-3= | + | |Conception-Type-3= erreur portant sur les démarches adoptées |
| − | + | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
}}<!-- ********************* FIN Fiche Typologie - Conceptions *********************--> | }}<!-- ********************* FIN Fiche Typologie - Conceptions *********************--> | ||
| Ligne 64 : | Ligne 59 : | ||
<!----*** Commencez les modifications Conceptions-ou-Concepts liés ***-----> | <!----*** Commencez les modifications Conceptions-ou-Concepts liés ***-----> | ||
| − | |Concept-lié-1= | + | |Concept-lié-1=la force de 2 bases faibles B1 et B2 de même concentration |
| − | |Concept-lié-2= | + | |Concept-lié-2=le coefficient le dissociation a |
| − | |Concept-lié-3= | + | |Concept-lié-3=la constante pKb |
| − | |Concept-lié-4= | + | |Concept-lié-4=l'échelle du pH |
| − | |Concept-lié-5= | + | |Concept-lié-5=la dilution d'une soluion basique |
| − | |Concept-lié-6= | + | |Concept-lié-6=la concentration d'une base |
| − | |||
| − | |||
| − | |||
| − | |||
}}<!-- ****************** FIN Concepts liés aux conceptions ************--> | }}<!-- ****************** FIN Concepts liés aux conceptions ************--> | ||
| Ligne 89 : | Ligne 80 : | ||
<!-- Remplacez, Adaptez, Ajoutez ou Supprimez les images et lignes non utilisées--> | <!-- Remplacez, Adaptez, Ajoutez ou Supprimez les images et lignes non utilisées--> | ||
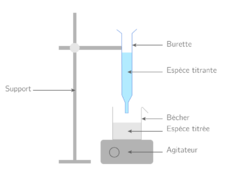
| − | Image: | + | Image:montage_titrage acido-basique.png|montage_titrage acido-basique |
| − | |||
| − | |||
| − | |||
</gallery><!-- ************** Fin modification images***************************--> | </gallery><!-- ************** Fin modification images***************************--> | ||
<!-- ************************* Début modification Vidéo ******************************************************************--> | <!-- ************************* Début modification Vidéo ******************************************************************--> | ||
| Ligne 102 : | Ligne 90 : | ||
<!-- ****************** Commercez les modifications pour les Vidéos *******************************************************--> | <!-- ****************** Commercez les modifications pour les Vidéos *******************************************************--> | ||
| − | <youtube width="220" height="220"> | + | <youtube width="220" height="220">https://www.youtube.com/watch?v=uj5awfuSiJI</youtube> |
| − | <youtube width="220" height="220"> | + | <youtube width="220" height="220">https://www.youtube.com/watch?v=NcDI1HOuIto</youtube> |
| − | + | ||
}}<!-- ************************* Fin modifications pour les Médias *******************************************************--> | }}<!-- ************************* Fin modifications pour les Médias *******************************************************--> | ||
| − | |||
= {{Widget:Stratégie de changement conceptuelle : Solutions possibles}} = | = {{Widget:Stratégie de changement conceptuelle : Solutions possibles}} = | ||
| Ligne 134 : | Ligne 121 : | ||
<!-- ************ Commercez les modifications *********************--> | <!-- ************ Commercez les modifications *********************--> | ||
| − | * [[ | + | * [[Comment déterminer la concentration inconnue d'une solution basique ?]] |
| − | + | ||
| − | |||
}}<!-- ******** Fin Fiche Didactique Questions ******************* --> | }}<!-- ******** Fin Fiche Didactique Questions ******************* --> | ||
| Ligne 148 : | Ligne 134 : | ||
<!-- ****************** Commercez les modifications *********************--> | <!-- ****************** Commercez les modifications *********************--> | ||
| − | * .. | + | * acides bases - exercice - Terminale ST2S - MOOC#1 [[https://www.youtube.com/watch?v=tF40PBrSpN4]] |
| − | |||
| − | |||
| − | |||
}}<!-- ************* Fin Fiche Didactique Bibliographie *************** --> | }}<!-- ************* Fin Fiche Didactique Bibliographie *************** --> | ||
{{Widget:Fiche-Conceptions-Bas}} | {{Widget:Fiche-Conceptions-Bas}} | ||
Version actuelle datée du 4 janvier 2020 à 08:19
 Conception : Clarification - Explicitation
Conception : Clarification - Explicitation
- La base la plus forte possède la valeur du pH la plus grande
Pour une base forte : Si Cb représente la concentration de la base alors [OH-]= Cb donc : pH = pKe + log Cb Pour une base faible : Si Cb représente la concentration de la base alors [OH-] <Cb donc pH < pKe + log Cb
De plus :
Pour une base forte : Le coefficient le dissociation a ; a = [OH-]/Cb = 1 Pour une base faible : Le coefficient le dissociation a ; a = [OH-]/Cb < 1 d'ou a augmente quand Cb diminue On peut conclure :
Pour une base forte : La réaction avec l'eau est totale: B + H2O →BH+ + OH- Pour une base faible : La réaction avec l'eau n'est pas totale: B + H2O<=>BH+ + OH-
![]() Conceptions erronées et origines possibles
Conceptions erronées et origines possibles
- la base la plus forte possède la valeur du pH la plus faible
![]() Conceptions: Origines possibles
Conceptions: Origines possibles
- Si l'individu ne connait pas l'échelle du pH alors ne sais plus le sens de basicité croissante donc ne peut pas faire une comparaison juste de deux acides
 Conceptions liées - Typologie
Conceptions liées - Typologie
 Concepts ou notions associés
Concepts ou notions associés
 Éléments graphique
Éléments graphique
 Stratégie de changement conceptuel
Stratégie de changement conceptuel
 Questions possibles
Questions possibles
 Bibliographie
Bibliographie
Pour citer cette page: (faible et base forte)
ABROUGUI, M & al, 2020. Base faible et base forte. In Didaquest [en ligne]. <http:www.didaquest.org/wiki/Base_faible_et_base_forte>, consulté le 21, novembre, 2024
- acides bases - exercice - Terminale ST2S - MOOC#1 [[1]]
Catégories :
- Sponsors Question
- Erreur liée aux opérations intellectuelles impliquées - Conceptions
- Erreur causée par la complexité du contenu - Conceptions
- Erreur portant sur les démarches adoptées - Conceptions
- Conceptions
- La force de 2 bases faibles B1 et B2 de même concentration - Conceptions
- Le coefficient le dissociation a - Conceptions
- La constante pKb - Conceptions
- L'échelle du pH - Conceptions
- La dilution d'une soluion basique - Conceptions
- La concentration d'une base - Conceptions
- Fiches Conceptions
- Fiche Conceptions