Différences entre versions de « La molécule »
| (19 versions intermédiaires par le même utilisateur non affichées) | |||
| Ligne 16 : | Ligne 16 : | ||
<!-- Remplacer et adapter le contenu --> | <!-- Remplacer et adapter le contenu --> | ||
| − | * | + | * Définition de la molécule: |
Une molécule est une entité chimique électriquement neutre et stable. Elle est formé par l'association d'un nombre limité d'atomes. | Une molécule est une entité chimique électriquement neutre et stable. Elle est formé par l'association d'un nombre limité d'atomes. | ||
[[catégorie:Superviseur Mimouni Jamila]] | [[catégorie:Superviseur Mimouni Jamila]] | ||
| Ligne 34 : | Ligne 34 : | ||
{{Widget:Fin-cadre-Bleu}} | {{Widget:Fin-cadre-Bleu}} | ||
| − | |||
== {{Widget:Definition-graphique-Fiche}} == | == {{Widget:Definition-graphique-Fiche}} == | ||
| Ligne 42 : | Ligne 41 : | ||
<!-- Remplacer et adapter le contenu --> | <!-- Remplacer et adapter le contenu --> | ||
| − | + | ||
| − | + | [[Fichier:molecule01.jpg |200 px|]]<!-- Remplacer et adapter le contenu --> | |
| − | [[Fichier: | ||
{{Widget:Fin-cadre-Bleu}} | {{Widget:Fin-cadre-Bleu}} | ||
| Ligne 61 : | Ligne 59 : | ||
= {{Widget:Exemples-applications-utilisations-Fiche}} = | = {{Widget:Exemples-applications-utilisations-Fiche}} = | ||
| − | * . | + | * Exemple: le camphre utilisé pour chauffer les muscles des sportifs: la molécule possède 10 atomes de carbone (boules noires); 16 atomes d'hydrogène (boules blanches); 1 atomes d'oxygène (boule rouge). |
| − | * . | + | formule brute C10H16O |
| + | * Molécule d’eau H2O : 2 atomes d’hydrogène et 1 atome d’oxygène molécule de méthane CH4 : 1 atome de carbone et 4 atomes d’hydrogène. | ||
| + | |||
| + | = {{Widget:Erreurs-confusions-Fiche}} = | ||
| + | * Le nom « molécule » provient du latin scientifique molecula, diminutif du nom latin moles, se traduisant par « masse ». | ||
| − | + | Le concept de molécule, sous sa forme actuelle, a été présenté la première fois en 1811 par Avogadro, qui a su surmonter la confusion faite à cette époque entre atomes et molécules, en raison des lois des proportions définies et multiples de John Dalton (1803-1808). | |
| − | + | L'analyse d'Avogadro a été acceptée par beaucoup de chimistes, à des exceptions notables (Boltzmann, Maxwell, Gibbs). Mais l'existence des molécules est restée en discussion ouverte dans la communauté scientifique jusqu'au travail de Jean Perrin (1911) qui a alors confirmé expérimentalement l'explication théorique du mouvement brownien en termes d'atomes proposée par Einstein (1905). Jean Perrin a également recalculé le nombre d'Avogadro par plusieurs méthodes. | |
| − | |||
= {{Widget:Questions-possibles-Fiche}} = | = {{Widget:Questions-possibles-Fiche}} = | ||
| − | * Question: | + | * Question: Comment fait-on pour déterminer la structure d'une molécule ? |
| − | |||
= {{Widget:Liens-enseignement-Fiche}} = | = {{Widget:Liens-enseignement-Fiche}} = | ||
Version actuelle datée du 27 janvier 2017 à 12:58
 Traduction
Traduction
La molécule (Français) / The molecule (Anglais) / جزيء (Arabe)
 Définition
Définition
- Domaine, Discipline, Thématique :
Définition écrite
Une molécule est une entité chimique électriquement neutre et stable. Elle est formé par l'association d'un nombre limité d'atomes.
La liaison dite covalente simple est la plus simple des liaisons que l'on puisse rencontrer entre deux atomes lorsque ceux-ci mettent en commun un unique électron de leur couche externe chacun. Les deux électrons en question forment ainsi un doublet liant. La structure d'une molécule est déterminée par le nombre de doublets d'électrons, liants ou non. Une molécule qui compte quatre liaisons covalentes simples, comme le méthane (CH4), présente une forme tétraédrique. En revanche, une molécule qui présente quatre liaisons covalentes dont une triple, comme l'acétylène (C2H2), sera de forme linéaire. L'objectif étant de minimiser les forces de répulsions entre doublets. Composition chimique et représentation des molécules: La formule chimique d'une molécule renseigne sur sa composition chimique. La molécule d'eau, de formule H2O, par exemple, est constituée de deux atomes d'hydrogène, H, et d'un atome d'oxygène, O. D'autres représentations peuvent renseigner sur la structure de la molécule comme par exemple les représentations suivantes : La formule développée fait apparaître les doublets d'électrons liants. Pour la molécule d'eau, on obtient : H - O - H ; La formule de Lewis figure les liaisons entre les atomes ainsi que les électrons de valence qui ne participent pas aux liaisons. C'est en quelque sorte, une formule développée plus complète ; La représentation de Cram met en évidence la structure de la molécule dans l'espace mais elle ne distingue pas les liaisons chimiques simples des liaisons doubles. |
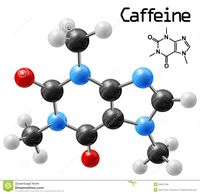
Définition graphique
 Concepts ou notions associés
Concepts ou notions associés
|
|
 Exemples, applications, utilisations
Exemples, applications, utilisations
- Exemple: le camphre utilisé pour chauffer les muscles des sportifs: la molécule possède 10 atomes de carbone (boules noires); 16 atomes d'hydrogène (boules blanches); 1 atomes d'oxygène (boule rouge).
formule brute C10H16O
- Molécule d’eau H2O : 2 atomes d’hydrogène et 1 atome d’oxygène molécule de méthane CH4 : 1 atome de carbone et 4 atomes d’hydrogène.
 Erreurs ou confusions éventuelles
Erreurs ou confusions éventuelles
- Le nom « molécule » provient du latin scientifique molecula, diminutif du nom latin moles, se traduisant par « masse ».
Le concept de molécule, sous sa forme actuelle, a été présenté la première fois en 1811 par Avogadro, qui a su surmonter la confusion faite à cette époque entre atomes et molécules, en raison des lois des proportions définies et multiples de John Dalton (1803-1808).
L'analyse d'Avogadro a été acceptée par beaucoup de chimistes, à des exceptions notables (Boltzmann, Maxwell, Gibbs). Mais l'existence des molécules est restée en discussion ouverte dans la communauté scientifique jusqu'au travail de Jean Perrin (1911) qui a alors confirmé expérimentalement l'explication théorique du mouvement brownien en termes d'atomes proposée par Einstein (1905). Jean Perrin a également recalculé le nombre d'Avogadro par plusieurs méthodes.
 Questions possibles
Questions possibles
- Question: Comment fait-on pour déterminer la structure d'une molécule ?
 Liaisons enseignements et programmes
Liaisons enseignements et programmes
- Portail Formation Gratuite
- Multisites Educatifs
- Sur DidaQuest
- Sur le Portail Didactique.info
- Sur le Portail Questions / Réponses
- Concept Sur Wikipedia
- Concept Sur Wikiwand
- Concept Sur Wikiversity
 Aides, Astuces,...
Aides, Astuces,...
=
 Difficultés liées à son enseignement =
Difficultés liées à son enseignement =
 Liens Internet
Liens Internet
- URL :
- URL :