Différences entre versions de « Acide »
| (30 versions intermédiaires par 3 utilisateurs non affichées) | |||
| Ligne 12 : | Ligne 12 : | ||
[[{{FULLPAGENAME}}]] (Français) | [[{{FULLPAGENAME}}]] (Français) | ||
| − | / [[ | + | / [[Acid]] (Anglais) |
| − | / [[ | + | / [[حامض]] (Arabe) |
| + | /[[кислота]] (Russe) | ||
}}<!-- ************** Fin Fiche Didactique Traduction ********************* --> | }}<!-- ************** Fin Fiche Didactique Traduction ********************* --> | ||
| Ligne 26 : | Ligne 27 : | ||
<!--****************** Commercez les modifications: Fiche-Disciplines-Thématiques *********************--> | <!--****************** Commercez les modifications: Fiche-Disciplines-Thématiques *********************--> | ||
| − | |Domaine-Discipline-Thématique-1= | + | |Domaine-Discipline-Thématique-1= Chimie |
|Domaine-Discipline-Thématique-2= Minéralogie | |Domaine-Discipline-Thématique-2= Minéralogie | ||
| − | |Domaine-Discipline-Thématique-3= | + | |Domaine-Discipline-Thématique-3= Organique |
| − | |Domaine-Discipline-Thématique-4= | + | |Domaine-Discipline-Thématique-4= Médicale |
| − | |Domaine-Discipline-Thématique-5= | + | |Domaine-Discipline-Thématique-5= Biologie |
|Domaine-Discipline-Thématique-6= | |Domaine-Discipline-Thématique-6= | ||
|Domaine-Discipline-Thématique-7= | |Domaine-Discipline-Thématique-7= | ||
| Ligne 49 : | Ligne 50 : | ||
<!-- *************** Commercez les modifications *******************--> | <!-- *************** Commercez les modifications *******************--> | ||
| − | *Un acide est un composé qui | + | * Un acide est un composé qui dans une solution aqueuse libère de l’hydrogène sous forme d’un [[proton]] H+. |
| − | + | * Définition selon d’Arrhénius (1887): Un acide est une substance qui libère dans l’eau l’ion H+. | |
| − | + | *Définition selon Broenstedt (1923):Un acide est un donneur de protons. | |
| − | * | + | *Définition selon Lewis (entre 1923 et 1938):Un acide est une substance qui peut s’attacher à une paire d’électrons |
| + | non appariés. | ||
<!-- ******** Fin Définition Générale ***************************** --> | <!-- ******** Fin Définition Générale ***************************** --> | ||
| Ligne 81 : | Ligne 83 : | ||
<!-- Remplacez, Adaptez, Ajoutez ou Supprimez les images et lignes non utilisées--> | <!-- Remplacez, Adaptez, Ajoutez ou Supprimez les images et lignes non utilisées--> | ||
Image:affiche-de-securite-acide-sulfurique-temime.gif|acide sulfurique | Image:affiche-de-securite-acide-sulfurique-temime.gif|acide sulfurique | ||
| − | Image: | + | Image:Acide+fort+et+faible+dissociation+complète+dissociation+partielle TEMIME.jpg|Acide fort et faible |
Image:liaison_chimique liberation d'atome H+TEMIME.jpg|libération d'atome H+ | Image:liaison_chimique liberation d'atome H+TEMIME.jpg|libération d'atome H+ | ||
| + | Image:reaction acide base TEMIME.jpg|réaction acide base | ||
| + | Image:Classement des acides et des bases temime.png|Classement des acides et des bases | ||
| + | Image:acide base temime.jpg|acide base | ||
| + | |||
| + | |||
</gallery><!-- ************** Fin modification images***************************--> | </gallery><!-- ************** Fin modification images***************************--> | ||
<!-- ************************* Début modification Vidéo ******************************************************************--> | <!-- ************************* Début modification Vidéo ******************************************************************--> | ||
| Ligne 89 : | Ligne 96 : | ||
/ WeGame : <wegame> / Tangler forum : <tangler> / Gametrailers: <gtrailer> / Nicovideo : <nicovideo> / GoGreenTube : <ggtube> -----> | / WeGame : <wegame> / Tangler forum : <tangler> / Gametrailers: <gtrailer> / Nicovideo : <nicovideo> / GoGreenTube : <ggtube> -----> | ||
<!-- <youtube>ID-Video</youtube> exemple http://www.youtube.com/watch?v=k0O8-0kPQmM devient <youtube>k0O8-0kPQmM</youtube> --> | <!-- <youtube>ID-Video</youtube> exemple http://www.youtube.com/watch?v=k0O8-0kPQmM devient <youtube>k0O8-0kPQmM</youtube> --> | ||
| + | |||
| + | |||
| + | |||
<!--Ajoutez ou supprimez les lignes non utilisées ---------------------------------------------------------------------------> | <!--Ajoutez ou supprimez les lignes non utilisées ---------------------------------------------------------------------------> | ||
<!-- ****************** Commercez les modifications pour les Vidéos *******************************************************--> | <!-- ****************** Commercez les modifications pour les Vidéos *******************************************************--> | ||
| − | <youtube width="220" height="220"> </youtube> | + | <youtube width="220" height="220">PwipDnh3fcI&t=106s</youtube> |
| − | <youtube width="220" height="220"> </youtube> | + | <youtube width="220" height="220">pT0LZFUgk-E</youtube> |
<youtube width="220" height="220">Dj5He0ZgWVg</youtube> | <youtube width="220" height="220">Dj5He0ZgWVg</youtube> | ||
| Ligne 109 : | Ligne 119 : | ||
|Mot-Clé-1= Acide | |Mot-Clé-1= Acide | ||
|Mot-Clé-2= Base | |Mot-Clé-2= Base | ||
| − | |Mot-Clé-3= | + | |Mot-Clé-3= Réaction acido-basique |
| − | |Mot-Clé-4= | + | |Mot-Clé-4= PH |
|Mot-Clé-5= Équation chimique | |Mot-Clé-5= Équation chimique | ||
|Mot-Clé-6= | |Mot-Clé-6= | ||
| Ligne 129 : | Ligne 139 : | ||
<!-- Compléter les pointillés et Supprimer les lignes non utilisées --> | <!-- Compléter les pointillés et Supprimer les lignes non utilisées --> | ||
<!-- ****************** Commercez les modifications *********************** --> | <!-- ****************** Commercez les modifications *********************** --> | ||
| + | * Pour mesurer l’acidité, on utilise un paramètre (le PH) et une échelle qui varie de 0 à 14. | ||
| + | * Les acides forts: l'acide chlorhydrique HCl; l'acide nitrique HNO3; l'acide sulfurique H2SO4 | ||
| − | * | + | * Les acides faibles: |
| − | + | : Acide organique : acide méthanoïque; acide carboxylique | |
| − | + | : Acides minéraux : acide fluorhydrique (HF); acide sulfureux (H2SO3) | |
| − | |||
| − | |||
}}<!--************** Fin Fiche Didactique Explicitations ******************* --> | }}<!--************** Fin Fiche Didactique Explicitations ******************* --> | ||
| Ligne 148 : | Ligne 158 : | ||
<!-- ****************** Commercez les modifications *************************--> | <!-- ****************** Commercez les modifications *************************--> | ||
| − | * Confusion entre [[ | + | * Confusion entre [[Acide - Base]] |
| − | * Confusion entre [[ | + | * Confusion entre [[Acide faible - Acide fort]] |
| − | * Erreur fréquente: | + | * Confusion entre [[Eau pure - Eau distillé - Eau]] |
| + | * Confusion entre [[Eau pure - Eau minérale]] | ||
| + | * Erreur fréquente: [[Conception péjorative des acides sur la santé]] | ||
| + | :* [[Les acides sont plus dangereux que les bases]] | ||
}}<!-- ************** Fin Fiche Didactique Conceptions ********************* --> | }}<!-- ************** Fin Fiche Didactique Conceptions ********************* --> | ||
| Ligne 163 : | Ligne 176 : | ||
<!-- ************ Commercez les modifications *********************--> | <!-- ************ Commercez les modifications *********************--> | ||
| − | |||
| − | |||
| − | |||
| + | * [[Qu'est-ce que le PH d'une solution ?]] | ||
| + | :* [[Qu'est-ce que le PH d'une solution ? | Comment savoir si une solution est acide ?]] | ||
| + | * [[Qu'est-ce que la constante d'acidité ?]] | ||
| + | :* [[Qu'est-ce que la constante d'acidité ? | Comment peut-on comparer des acides entres eux ?]] | ||
| + | * [[A quoi sert l'acide gastrique?]] | ||
}}<!-- ******** Fin Fiche Didactique Questions ******************* --> | }}<!-- ******** Fin Fiche Didactique Questions ******************* --> | ||
| Ligne 181 : | Ligne 196 : | ||
<!-- ****************** Commercez les modifications ************************** --> | <!-- ****************** Commercez les modifications ************************** --> | ||
| − | * . | + | * [[lhce.lu - Acide - Base]] |
| − | :* | + | :* [[Lachimie]] |
* .................. | * .................. | ||
:* ................. | :* ................. | ||
}}<!-- ************************* Fin Idées-Enseignement ********************** --> | }}<!-- ************************* Fin Idées-Enseignement ********************** --> | ||
| − | |||
== {{Widget:Aides et astuces-Fiche}} == | == {{Widget:Aides et astuces-Fiche}} == | ||
| Ligne 198 : | Ligne 212 : | ||
<!-- ****************** Commercez les modifications ************************** --> | <!-- ****************** Commercez les modifications ************************** --> | ||
| − | * .. | + | * Acides en géologie: |
| − | + | En géologie, on dit qu’une pierre est acide si elle renferme plus de 65 % de silice. | |
| − | + | La silice qui est un accepteur d’ion oxyde O2- est acide. | |
| − | + | ||
| + | SiO + HO = HSiO | ||
| + | |||
| + | Donc les roches riches en silice sont acides, les roches riches en calcaire sont basiques. Cela a une importance pour comprendre le comportement des magmas (notamment dans les volcans), et lorsque l’on veut dissoudre une roche pour l’analyser, par exemple dissolution dans un acide pour analyse par ICP ou bien dissolution dans un verre pour analyse par spectrométrie de fluorescence X. | ||
| + | |||
| + | |||
}}<!-- ************************* Fin Astuces-Enseignement ********************** --> | }}<!-- ************************* Fin Astuces-Enseignement ********************** --> | ||
Version actuelle datée du 13 décembre 2018 à 21:45
 Traduction
Traduction
 Définition
Définition
Domaine, Discipline, Thématique
Définition écrite
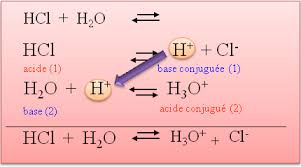
- Un acide est un composé qui dans une solution aqueuse libère de l’hydrogène sous forme d’un proton H+.
- Définition selon d’Arrhénius (1887): Un acide est une substance qui libère dans l’eau l’ion H+.
- Définition selon Broenstedt (1923):Un acide est un donneur de protons.
- Définition selon Lewis (entre 1923 et 1938):Un acide est une substance qui peut s’attacher à une paire d’électrons
non appariés.
....................................................................... ....................................................................... .......................................................................
....................................................................... ....................................................................... |
Définition graphique
 Concepts ou notions associés
Concepts ou notions associés
 Exemples, applications, utilisations
Exemples, applications, utilisations
|
 Erreurs ou confusions éventuelles
Erreurs ou confusions éventuelles
- Confusion entre Acide - Base
- Confusion entre Acide faible - Acide fort
- Confusion entre Eau pure - Eau distillé - Eau
- Confusion entre Eau pure - Eau minérale
- Erreur fréquente: Conception péjorative des acides sur la santé
 Questions possibles
Questions possibles
 Liaisons enseignements et programmes
Liaisons enseignements et programmes
Idées ou Réflexions liées à son enseignement
Aides et astuces
- Acides en géologie:
En géologie, on dit qu’une pierre est acide si elle renferme plus de 65 % de silice. La silice qui est un accepteur d’ion oxyde O2- est acide.
SiO + HO = HSiO
Donc les roches riches en silice sont acides, les roches riches en calcaire sont basiques. Cela a une importance pour comprendre le comportement des magmas (notamment dans les volcans), et lorsque l’on veut dissoudre une roche pour l’analyser, par exemple dissolution dans un acide pour analyse par ICP ou bien dissolution dans un verre pour analyse par spectrométrie de fluorescence X.
Education: Autres liens, sites ou portails
 Bibliographie
Bibliographie
Pour citer cette page: ([1])
ABROUGUI, M & al, 2018. Acide. In Didaquest [en ligne]. <http:www.didaquest.org/wiki/Acide>, consulté le 21, novembre, 2024
- ..................
- ..................
- ..................
- ..................