Différences entre versions de « Virus »
| Ligne 186 : | Ligne 186 : | ||
[[Fichier:Un virus à l'intérieur de memb de cellule infectée.png|vignette|Un_virus_à_l'intérieur_de_memb_de_cellule_infectée.png]] | [[Fichier:Un virus à l'intérieur de memb de cellule infectée.png|vignette|Un_virus_à_l'intérieur_de_memb_de_cellule_infectée.png]] | ||
| − | L'enveloppe virale est constituée par des éléments provenant de la membrane plasmique (bicouches lipidiques et protéines) de la cellule hôte ou du virus. Les virus remplacent cependant les protéines membranaires d'origine par leurs propres protéines, en particulier des glycoprotéines qui "pointent" et leur permettent de reconnaitre leurs cellules cibles et de se fixer à leur surface. | + | a-'''L'enveloppe virale''' est constituée par des éléments provenant de la membrane plasmique (bicouches lipidiques et protéines) de la cellule hôte ou du virus. Les virus remplacent cependant les protéines membranaires d'origine par leurs propres protéines, en particulier des glycoprotéines qui "pointent" et leur permettent de reconnaitre leurs cellules cibles et de se fixer à leur surface. |
De nombreux virions sont donc recouverts de glycoprotéines ce qui leur confèrent l'aptitude à "communiquer" avec leur cellule hôte : le potentiel infectieux d'un virus dépend entièrement des glycoprotéines qui le caractérisent. | De nombreux virions sont donc recouverts de glycoprotéines ce qui leur confèrent l'aptitude à "communiquer" avec leur cellule hôte : le potentiel infectieux d'un virus dépend entièrement des glycoprotéines qui le caractérisent. | ||
De plus la membrane / enveloppe qui entoure les virus enveloppés leur permet d'entrer dans la cellule hôte par un mécanisme de fusion des membranes. | De plus la membrane / enveloppe qui entoure les virus enveloppés leur permet d'entrer dans la cellule hôte par un mécanisme de fusion des membranes. | ||
| + | '''la glycoprotéine d'enveloppe Env du rétrovirus (lentivirus) HIV-1''': | ||
| + | Cette glycoprotéine est synthétisée sous forme d'un précurseur appelé gp160 (PDB 4CC8) très flexible et recouvert de glucides. Ce précurseur est hydrolysé : | ||
| + | En une sous-unité gp120 exposée à la surface et impliquée dans la liaison au récepteur CD4 de la cellule hôte. | ||
| + | En une sous-unité gp41 ancrée dans la membrane du virus et impliquée dans la fusion des membranes virale et cellulaire. | ||
| + | Les sous-unités gp120 et gp41 s'associent de manière non covalente pour former un trimère d'hétérodimère [gp120-gp41]3. Du point de vue ultra-structural, elles forment des "pointes" dans l'enveloppe du virion. | ||
| + | Le trimère [gp120-gp41]3 du HIV-1 interagit avec le récepteur primaire CD4 et un corécepteur (tel que le récepteur de la chimiokine CCR5, un RCPG) pour fusionner les membranes du virus et de la cellule cible. | ||
| + | |||
| + | L'interaction entre gp120 et le corécepteur semble l'élément déclencheur de l'acquisition du potentiel de fusion de gp41. | ||
| + | |||
| + | Le récepteur CD4 ("Cluster of Differentiation 4") est une glycoprotéine présente à la surface de cellules immunitaires (cellules T auxiliaires, monocytes, macrophages, cellules dendritiques). | ||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | [[Fichier:Glycoproteine de l'enveloppe du rétrovirus.png|vignette|Glycoproteine_de_l'enveloppe_du_rétrovirus.png]] | ||
| + | |||
| + | |||
| + | '''b. Incorporation des glycoprotéines dans l'enveloppe virale''' | ||
| + | |||
| + | L'appareil de synthèse des protéines de la cellule hôte ("producer cell") est utilisé pour synthétiser les glycoprotéines de la future enveloppe virale Env (figure ci-dessous). | ||
| + | Ces glycoprotéines sont ensuite glycosylées et repliées correctement dans le réticulum endoplasmique de cette même cellule hôte. | ||
| + | Elles sont enfin sécrétées (après transit par l'appareil de Golgi) et enchâssées dans la membrane de la cellule hôte. Elle sont alors prêtes à être recrutées par les nouvelles particules bourgeonnantes des virions en cours de formation. | ||
| + | La synthèse de protéines virales dans la cellule hôte peut provoquer un stress dans le réticulum endoplasmique : les cellules hôtes disposent d'un mécanisme (appelé "Unfolded Protein Response" - UPR) pour répondre au stress lié à l'accumulation de protéines mal repliées dans le réticulum endoplasmique et ainsi l'atténuer. | ||
| + | |||
| + | Une particularité importante de l'UPR est sa capacité à augmenter la voie de dégradation des protéines associée au réticulum endoplasmique ("ER-Associated protein Degradation pathway" - ERAD), notamment via son mécanisme de contrôle de la qualité du repliement des protéines. C'est donc une "lutte évolutive" incessante entre les virus et la machinerie ERAD de leurs hôtes. | ||
| + | |||
| + | Modèles (non mutuellement exclusifs) d'incorporation des glycoprotéines Env dans l'enveloppe virale de nouveaux virions | ||
| + | |||
| + | '''Mécanisme 1''' (figure ci-dessous) : les glycoprotéines Env à la surface de la cellule hôte pourraient être incorporées passivement dans les virions à mesure que les particules virales acquièrent une membrane dérivée de l'hôte pendant l'assemblage et le bourgeonnement. | ||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | [[Fichier:Incorporation de l'enveloppe dans les virions.png|vignette|Incorporation_de_l'enveloppe_dans_les_virions.png]] | ||
| + | |||
| + | |||
| + | |||
| + | |||
| + | lipidique", concentrant ainsi Env sur les sites d'assemblage. | ||
| + | '''Mécanisme 3''' : des données expérimentales suggèrent que le domaine de la protéine Gag orienté vers la matrice et la queue de la sous-unité gp41 orientée vers le cytoplasme (voir ci-dessous) de la protéine Env interagissent, ce qui induit la rétention des complexes Env au niveau des sites de bourgeonnement et leur recrutement dans les virions. | ||
| + | '''Mécanisme 4''' : cette interaction pourrait être indirecte par le biais d'une protéine de l'hôte reliant les deux protéines virales. | ||
Version du 4 décembre 2020 à 00:42
 Traduction
Traduction
 Définition
Définition
Domaine, Discipline, Thématique
Santé / Microbiologie / Hygiène / Immunologie / Microbiologie / Medecine / Biologie cellulaire /
Définition écrite
Modèle:Les virus sont des parasites de tous les types de vie cellulaire car ils ne peuvent pas se reproduire. Ils infectent une cellule hôte et utilise sa machinerie pour produire d'autres particules de virus.
La particule virale infectieuse, appelée virion, est constituée d'un acide nucléique (ADN ou ARN) entouré d'une enveloppe protéique, la capside, constituée de nombreux exemplaires d'un ou plusieurs types de protéines. Les virus sont des parasites de tous les types de vie cellulaire car ils ne peuvent pas se reproduire. Ils infectent une cellule hôte et utilise sa machinerie pour produire d'autres particules de virus.
La particule virale infectieuse, appelée virion, est constituée d'un acide nucléique (ADN ou ARN) entouré d'une enveloppe protéique, la capside, constituée de nombreux exemplaires d'un ou plusieurs types de protéines. Les virus représentent la forme de vie la plus abondante et la plus diverse sur Terre. Ils peuvent infecter tous types d'organismes (vertébrés et invertébrés, plantes, champignons, bactéries, archées).
Les virus qui infectent les bactéries sont appelés bactériophages ou phages : ils représentent la forme biologique la plus abondante dans la biosphère avec environ 4,8 1031 phages (10 fois plus nombreux que les bactéries) et une biomasse estimée à 200 millions de tonnes.
Les océans (environ 70% de la surface de la Terre) représentent le principal réservoir de virus : chaque mL d'eau de mer contient environ 107 - 108 phages et environ 1023 infections par des phages se produisent chaque seconde. Les virus des archées jouent un rôle majeur dans la formation des sédiments océaniques en tuant leurs hôtes : cela entraîne la libération de 3 à 5 108 tonnes de carbone par an. L'intestin des mammifères est également densément peuplé : 1013 - 1014 bactéries et jusqu'à 108 particules virales (la plupart étant des bactériophages) par gramme de matière fécale (les phages d'Escherichia coli dominant : 103 - 104 phages chez l'homme et jusqu'à 107 chez la vache et le porc). Il est admis que les virus sont polyphylétiques et différents scénarios quant à leur origine sont envisagés :
Une évolution à partir d'éléments génétiques primordiaux pré-cellulaires. A l'inverse, une régression d'ancêtres cellulaires. La "fuite" de gènes d'hôtes d'origine qui auraient acquis une autonomie de réplication partielle et auraient été transformés en éléments génétiques parasitaires. L'étude des virus de plantes est à l'origine des premières expériences de biologie moléculaire. En 1935, Wendell Stanley (co-lauréat avec John Howard Northrop du Prix Nobel de chimie en 1946 "for their preparation of enzymes and virus proteins in a pure form") a purifié et partiellement cristallisé le virus de la mosaïque du tabac (dont il attaque les feuilles).
Infections virales médiatisées : virus du chikungunya (moustique "tigre" Aedes albopictus ou Aedes aegypti), virus de la dengue (moustiques du genre Aedes), virus HIV-1 (sida), virus Zika (Flavivirus, moustiques du genre Aedes).
exemple
Les virus de la grippe
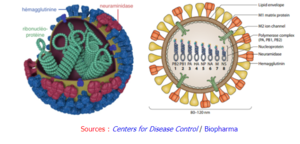
Il existe 4 types de virus de la grippe : A, B, C et D. Le type A est celui dont l'infection est la plus virulente chez l'homme.
Ce sont des virus à ARN qui codent jusqu'à 11 protéines dont l'hémagglutinine (HA) et la neuramidase (NA) : ces protéines ont une structure semblable à des pointes ("spike-like proteins") à la surface du virus (figure de gauche ci-dessous). Les sous-types du virus de la grippe A correspondent à 18 variants de HA et 11 variants de NA (figure de droite ci-dessous) : les nombres H et N indiquent la souche du virus (exemples : H1N1, H5N1 ou virus de la grippe aviaire).
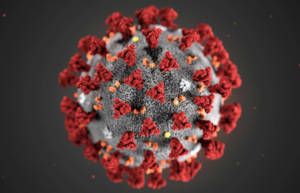
Le coronavirus SARS-CoV-2 ("Severe Acute Respiratory Syndrome COronaVirus 2", francisé en SRAS-CoV-2 (Syndrome Respiratoire Aigu Sévère), initialement 2019-nCoV puis "SARS-CoV-2 isolate Wuhan-Hu-1 genome". SARS-CoV-2 utilise une ARN polymérase ARN dépendante pour la réplication de son génome et la transcription de ses gènes. Ce virus est responsable de la maladie Covid-19 ("Co" : corona, "vi" : virus, "d" : disease, "19" : 2019). Figure ci-dessous : particules virales libérées de la surface d'une cellule infectée par le coronavirus SARS-CoV-2
Source de l'image : Nicholls et al., Université de Hong Kong
MERS-CoV : "Middle East Respiratory Syndrome COronaVirus" ou coronavirus du syndrome respiratoire du Moyen-Orient.
SADS-CoV : "Swine Acute Diarrhoea Syndrome COronaVirus" ou coronavirus du syndrome de diarrhée aiguë porcine. Quatre autres coronavirus humains (HCoV-NL63, HCoV-229E, HCoV-OC43 et HKU1) induisent des maladies respiratoires supérieures légères chez des hôtes immunocompétents.
Quelques définitions
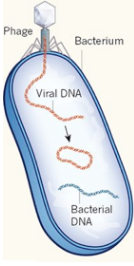
Phage : un virus qui infecte un procaryote (bactérie et archée). Bactériophage : un virus qui infecte les bactéries. Exemples : phage λ, T2, T4, φ174, MV-11 Prophage : nom donné au génome d'un bactériophage quand il est intégré dans le chromosome de la bactérie hôte ou inséré dans cette batérie sous forme d'un plasmide extrachromosomique. C'est une forme latente du bactériophage qui ne perturbe pas la bactérie (phase lysogène)
Virophage : un virus qui infecte un autre virus. Exemple : le virophage Spoutnik est un virus satellite qui se reproduit dans des cellules infectées par un virus assistant. Spoutnik utilise le virus assistant comme hôte pour la reproduction et inhibe la réplication de ce dernier. Le virus assistant est Mamavirus, un grand virus (famille Mimiviridae). Virulence : elle peut être définie de différentes manières. La définition la plus simple est la sévérité ou la nocivité d'un agent pathogène. Virus enveloppé : virus entouré d'une bicouche lipidique dérivée de la membrane de la cellule hôte. Cette enveloppe protège le contenu du virion (voir ci-dessous) et contient, parmi d'autres protéines dérivées de la cellule hôte ou codées par le génome du virus, les protéines virales nécessaires à la fixation, à la fusion et à l'entrée du virus dans la cellule hôte. Récepteurs de la cellule hôte : ils sont la cible des glycoprotéines de fusion d'un virus enveloppé pour sa fixation spécifique à la cellule hôte et l'initiation de la cascade des évènements [fusion - entrée]. Virion : forme de transport d'un virus entre cellules. La maturation des virions a lieu après la sortie de la particule infectieuse virale de la cellule hôte soit par bourgeonnement soit par scellement de la capside sphérique. Cette maturation est un réarrangement et/ou un clivage irréversibles des protéines du virus qui activent le virion et le rendent compétent pour la réinfection.
Les virus n'ont pas de structure cellulaire et ne peuvent pas effectuer de réactions métaboliques. En revanche, ils utilisent la machinerie métabolique et génétique de la cellule hôte qu'ils infectent pour se multiplier.
On peut les considérer comme des "parasites génétiques" et non comme des êtres vivants indépendants. Les caractéristiques structurales et fonctionnelles de leurs gènes sont semblables à celles des gènes de leurs cellules hôtes.
Contrairement aux génomes des autres êtres vivants, composés exclusivement d'ADN, certains génomes viraux sont constitués d'ARN. Certains virus sont dits à ARN négatif car leur matériel génétique est complémentaire de celui d'un ARN messager (qualifié de positif) et donc "illisible" par la cellule hôte.
Leur génome contient un nombre variable de gènes.
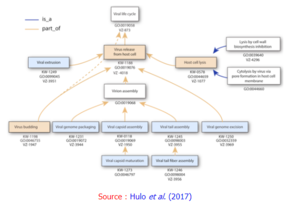
Exemple d'ontologie (termes et numéros d'accession GO, "Gene Ontology") des évènements clés du cycle de vie d'un virus (VZ : page de la base de données ViralZone; KW : mot clé UniProtKB)
Exemples de classification des virus - Les virus géants
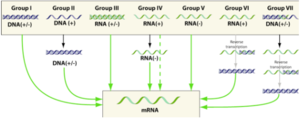
- Groupes des virus à ADN : groupe I = virus à ADN double brin ("double-stranded DNA virus" - "dsDNA"); groupe II = virus à ADN simple brin ("single-stranded DNA virus" - "ssDNA")
- Groupes des virus à ARN : groupe III = virus à ARN double brin; groupe IV = virus à ARN simple brin à polarité positive ("single-stranded RNA virus, positive-sense"); groupe V = virus à ARN simple brin à polarité négative ("single-stranded RNA virus, negative-sense")
- Groupes des virus (ADN ou ARN) à transcriptase inverse ("reverse transcriptase") : groupe VI = rétrovirus à ARN simple brin ("ssRNA(RT)"); groupe VII = rétrovirus à ADN double brin ("dsRNA(RT)")
Classification selon la méthode de David Baltimore sur la structure du génome :
- Group I : dsDNA ("double-stranded DNA") viruses; group II : ssDNA ("single-stranded DNA") viruses
- Group III : dsRNA ("double-stranded RNA") viruses
- Group IV : (+)sense RNA viruses; group V : (-)sense RNA viruses
- Group VI : positive-sense single-stranded RNA viruses that replicate through a DNA intermediate (retroviruses - reverse transcriptase to convert the positive-sense RNA into DNA).
- Group VII : double-stranded DNA viruses that replicate through a single-stranded RNA intermediate (pararetrovirus - reverse transcriptase)
David Baltimore a été co-lauréat du Prix Nobel de physiologie ou médecine en 1975 pour la découverte de la transcriptase inverse (enzyme des rétrovirus), conjointement à Renato Dulbecco et Howard Martin Temin "pour leurs découvertes concernant l'interaction entre les virus tumoraux et le matériel génétique de la cellule"
Classification de quelques familles de virus selon leur taille
- Geminivirus (15 - 20 nm) : génome à ADN, 2500 paires de bases.
- Phycodnavirus (110 nm) : génome à ADN double brin, 160.000 - 560.000 paires de bases.
- Iridovirus : (150 - 200 nm) : génome à ADN double brin, 100.000 - 220.000 paires de bases, environ 90 - 210 protéines prédites.
- Poxvirus (300 nm) : génome à ADN double brin, 130.000 - 300.000 paires de bases.
- Mimivirus (750 nm) : découverts en 2003 (Acanthamoeba polyphaga). Génome à ADN double brin (1,2 millions de paires de bases codant environ 900 protéines).
- Pandoravirus (1000 nm) : découverts en 2013. Ils possèdent un génome à ADN double brin avec la plus grande taille (2,5 millions de paires de bases, environ 2500 gènes) de tous les virus connus.
- Tupanvirus (Mimiviridae - 1200 nm) : découverts en 2018. Génome à ADN double brin (1,4 - 1,5 millions de paires de bases, 1276 à 1425 protéines prédites). Ces virus possèdent l'appareil de traduction le plus complet de la virosphère : en particulier, 70 ARN de transfert, 20 aminoacyl-tRNA synthétases, 11 facteurs pour les différentes étapes de la traduction, plusieurs facteurs de maturation des ARN de transfert et des ARN messagers .
- Pithovirus (1500 nm) : virus géant découvert en 2013. Il possède un chromosome circulaire à ADN double brin d'environ 610.000 paires de bases (467 gènes).
- Klothovirus (2500 nm) : virus géant mis en évidence en 2019 après ré-analyse de clichés anciens.
Les virus dits géants (découverts très récemment) ou virus à grand ADN nucléo-cytoplasmique ("NucleoCytoplasmic Large DNA Viruses", NCLDV) constituent l'un des plus grands groupes de virus qui infectent une grande variété d'hôtes eucaryotes. Exceptés les Poxvirus, les Pandoravirus et les Ascovirus, ils ont une forme approximativement icosaédrique. Les connaissances sur les NCLDV sont principalement dérivées d'isolats viraux co-cultivés avec des protistes et des algues. Cependant, 2074 génomes de NCLDV ont été reconstruits à partir d'échantillons prélevés à travers le monde et les données des métagénomes (Schulz et al., 2020).
- Le résultat est une augmentation de la diversité fonctionnelle et phylogénétique d'un facteur 10 et d'un facteur 11, respectivement.
- L'analyse de plus de 58.000 protéines majeures des capsides de grands virus et de virus géants à l'aide de données métagénomiques a permis d'établir un schéma de la distribution mondiale et de la nature cosmopolite de ces types de virus.
- Les génomes viraux découverts codent une large gamme de protéines avec des rôles potentiels dans la photosynthèse et divers processus de transport, ce qui indique que la reprogrammation de l'hôte est probablement une stratégie courante des NCLDV.
La diversité des NCLDV (qui sont par ailleurs associés aux principales lignées des eucaryotes) est en faveur de l'hypothèse qu'ils sont des acteurs importants des écosystèmes à travers les biomes.
Les phages à très grand génome et leurs systèmes CRISPR-Cas
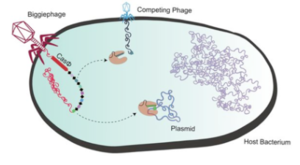
Les bactériophages ont généralement de petits génomes. Cependant, il existe des centaines de génomes de phages de plus de 200.000 paires de bases, jusqu'à 735.000 paires de bases. Dix clades de phages ont été identifiés et nommés : Mahaphage, Kabirphage, Dakhmphage, Jabbarphage, Kyodaiphage, Biggiephage, Whopperphage, Judaphage, Enormephage et Kaempephage (Al-Shayeb et al., 2020).
Les répertoires génétiques de ces phages à très grand génome contiennent divers systèmes CRISPR-Cas, des ARN de transfert (ARNt), des ARNt synthétases, des enzymes de modification de l'ARNt, des facteurs d'initiation et d'élongation de la traduction et des protéines ribosomales.
Les systèmes CRISPR-Cas de ces phages ont la capacité de réduire au silence les facteurs de transcription de la bactérie hôte et donc les gènes qui devraient être transcrits.
Les Biggiephages possèdent un système CRISPR-Cas très particulier :
Leur enzyme Cas (une seule protéine d'environ 70 kDa) a une taille environ la moitié de celles des autres systèmes CRISPR-Cas. Cette protéine Cas-Φ virale, plus petite et plus compacte, est donc plus facile à transporter dans les cellules pour éditer leur génome, car elles peuvent être emballées dans de petits systèmes de transport, notamment le virus désactivé appelé virus adéno-associé ("Adeno-Associated Virus" - AAV)
Entrée des virus enveloppés dans la cellule hôte
La reconnaissance et la fixation sur la cellule hôte est le préalable à toute infection par un virus. La membrane des cellules est caractérisée par de nombreux types de macromolécules (protéines, glycérophospholipides, glycanes, ...) dont le nombre, la structure et la composition sont la signature des cellules.
En conséquence, les nombreux virus ciblent ces macromolécules (qu'on appelle récepteurs) pour entrer dans la cellule hôte.
a-L'enveloppe virale est constituée par des éléments provenant de la membrane plasmique (bicouches lipidiques et protéines) de la cellule hôte ou du virus. Les virus remplacent cependant les protéines membranaires d'origine par leurs propres protéines, en particulier des glycoprotéines qui "pointent" et leur permettent de reconnaitre leurs cellules cibles et de se fixer à leur surface.
De nombreux virions sont donc recouverts de glycoprotéines ce qui leur confèrent l'aptitude à "communiquer" avec leur cellule hôte : le potentiel infectieux d'un virus dépend entièrement des glycoprotéines qui le caractérisent. De plus la membrane / enveloppe qui entoure les virus enveloppés leur permet d'entrer dans la cellule hôte par un mécanisme de fusion des membranes.
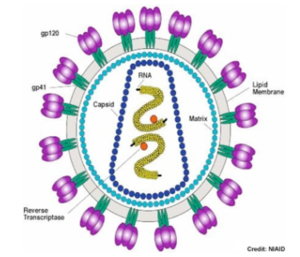
la glycoprotéine d'enveloppe Env du rétrovirus (lentivirus) HIV-1:
Cette glycoprotéine est synthétisée sous forme d'un précurseur appelé gp160 (PDB 4CC8) très flexible et recouvert de glucides. Ce précurseur est hydrolysé :
En une sous-unité gp120 exposée à la surface et impliquée dans la liaison au récepteur CD4 de la cellule hôte. En une sous-unité gp41 ancrée dans la membrane du virus et impliquée dans la fusion des membranes virale et cellulaire. Les sous-unités gp120 et gp41 s'associent de manière non covalente pour former un trimère d'hétérodimère [gp120-gp41]3. Du point de vue ultra-structural, elles forment des "pointes" dans l'enveloppe du virion.
Le trimère [gp120-gp41]3 du HIV-1 interagit avec le récepteur primaire CD4 et un corécepteur (tel que le récepteur de la chimiokine CCR5, un RCPG) pour fusionner les membranes du virus et de la cellule cible.
L'interaction entre gp120 et le corécepteur semble l'élément déclencheur de l'acquisition du potentiel de fusion de gp41.
Le récepteur CD4 ("Cluster of Differentiation 4") est une glycoprotéine présente à la surface de cellules immunitaires (cellules T auxiliaires, monocytes, macrophages, cellules dendritiques).
b. Incorporation des glycoprotéines dans l'enveloppe virale
L'appareil de synthèse des protéines de la cellule hôte ("producer cell") est utilisé pour synthétiser les glycoprotéines de la future enveloppe virale Env (figure ci-dessous). Ces glycoprotéines sont ensuite glycosylées et repliées correctement dans le réticulum endoplasmique de cette même cellule hôte. Elles sont enfin sécrétées (après transit par l'appareil de Golgi) et enchâssées dans la membrane de la cellule hôte. Elle sont alors prêtes à être recrutées par les nouvelles particules bourgeonnantes des virions en cours de formation. La synthèse de protéines virales dans la cellule hôte peut provoquer un stress dans le réticulum endoplasmique : les cellules hôtes disposent d'un mécanisme (appelé "Unfolded Protein Response" - UPR) pour répondre au stress lié à l'accumulation de protéines mal repliées dans le réticulum endoplasmique et ainsi l'atténuer.
Une particularité importante de l'UPR est sa capacité à augmenter la voie de dégradation des protéines associée au réticulum endoplasmique ("ER-Associated protein Degradation pathway" - ERAD), notamment via son mécanisme de contrôle de la qualité du repliement des protéines. C'est donc une "lutte évolutive" incessante entre les virus et la machinerie ERAD de leurs hôtes.
Modèles (non mutuellement exclusifs) d'incorporation des glycoprotéines Env dans l'enveloppe virale de nouveaux virions
Mécanisme 1 (figure ci-dessous) : les glycoprotéines Env à la surface de la cellule hôte pourraient être incorporées passivement dans les virions à mesure que les particules virales acquièrent une membrane dérivée de l'hôte pendant l'assemblage et le bourgeonnement.
lipidique", concentrant ainsi Env sur les sites d'assemblage.
Mécanisme 3 : des données expérimentales suggèrent que le domaine de la protéine Gag orienté vers la matrice et la queue de la sous-unité gp41 orientée vers le cytoplasme (voir ci-dessous) de la protéine Env interagissent, ce qui induit la rétention des complexes Env au niveau des sites de bourgeonnement et leur recrutement dans les virions.
Mécanisme 4 : cette interaction pourrait être indirecte par le biais d'une protéine de l'hôte reliant les deux protéines virales.
- ......................................................................
.......................................................................
.......................................................................
....................................................................... ....................................................................... .......................................................................
....................................................................... ....................................................................... |
Définition graphique
 Concepts ou notions associés
Concepts ou notions associés
infection virale / parasite / cellule hôte / ARN / ADN / Bactériophage / génome / capside / multiplication virale /
 Exemples, applications, utilisations
Exemples, applications, utilisations
................................................................................ ................................................................................ ................................................................................
................................................................................ ................................................................................ ................................................................................ |
 Erreurs ou confusions éventuelles
Erreurs ou confusions éventuelles
- Confusion entre ....... - ........
- Confusion entre ....... - ........
- Erreur fréquente: ....................
 Questions possibles
Questions possibles
- Qu'est ce qu'un phage?
- C'est quoi un bactériophage?
- C'est quoi un virophage?
- Qu'est ce qu'il différencie un virus enveloppé?
- Quelles sont les constituants d'un enveloppe de virus?
- Comment se fait la synthèse des protéines virales dans la cellule hôte?
- Quel est le mécanisme de fusion: enveloppe du virus-membrane de l'hôte?
- quel est la Modification subséquente de la membrane de l'hôte par les protéines de la capside des virus non enveloppés?
- comment se fait l'intégration du génome viral?
- comment se fait la réplication et transcription du génome viral et la traduction des protéines virales?
- Quel est le mécanisme des médicaments antiviraux?
- ..................?
- ..................?
- ..................?
 Liaisons enseignements et programmes
Liaisons enseignements et programmes
Idées ou Réflexions liées à son enseignement
Aides et astuces
Education: Autres liens, sites ou portails
 Bibliographie
Bibliographie
Pour citer cette page: ([1])
ABROUGUI, M & al, 2020. Virus. In Didaquest [en ligne]. <http:www.didaquest.org/wiki/Virus>, consulté le 4, mai, 2025
- ..................
- ..................
- ..................
- ..................