Différences entre versions de « Osmose »
| Ligne 48 : | Ligne 48 : | ||
|Définition= <!-- Ne pas Modifier --> | |Définition= <!-- Ne pas Modifier --> | ||
<!-- *************** Commercez les modifications *******************--> | <!-- *************** Commercez les modifications *******************--> | ||
| − | L'osmose est | + | |
| − | + | L'osmose est le passage de molécules de solvant, en général de l'eau, à travers une membrane semi-perméable (qui laisse passer uniquement l'eau), depuis le milieu le moins concentré (hypotonique) en solutés vers celui le plus concentré (hypertonique).==(Diffusion de la matière) | |
| + | Ce phénomène s'arrête lorsque les deux liquides séparés par la membrane ont atteint la même concentration. On parle alors de milieux isotoniques. La pression hydrostatique due à la différence de hauteur d'eau entre ces deux milieux compense alors la pression osmotique. | ||
<!-- ******** Fin Définition Générale ***************************** --> | <!-- ******** Fin Définition Générale ***************************** --> | ||
| Ligne 56 : | Ligne 57 : | ||
|Typologie= <!------------------------------------ Ne pas Modifier --> | |Typologie= <!------------------------------------ Ne pas Modifier --> | ||
<!-- ****************** Commercez les modifications ****************--> | <!-- ****************** Commercez les modifications ****************--> | ||
| − | + | ||
| − | + | par une membrane semi-perméable. | |
| − | par une membrane semi-perméable | ||
}}<!-- ******** Fin Fiche Didactique Définition ******************* --> | }}<!-- ******** Fin Fiche Didactique Définition ******************* --> | ||
Version du 9 janvier 2021 à 23:30
 Traduction
Traduction
 Définition
Définition
Domaine, Discipline, Thématique
Définition écrite
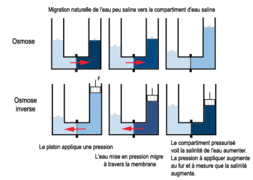
L'osmose est le passage de molécules de solvant, en général de l'eau, à travers une membrane semi-perméable (qui laisse passer uniquement l'eau), depuis le milieu le moins concentré (hypotonique) en solutés vers celui le plus concentré (hypertonique).==(Diffusion de la matière)
Ce phénomène s'arrête lorsque les deux liquides séparés par la membrane ont atteint la même concentration. On parle alors de milieux isotoniques. La pression hydrostatique due à la différence de hauteur d'eau entre ces deux milieux compense alors la pression osmotique.
|
par une membrane semi-perméable. |
Définition graphique
 Concepts ou notions associés
Concepts ou notions associés
 Exemples, applications, utilisations
Exemples, applications, utilisations
|
Le principe d'osmose est appliqué dans plusieurs domaines tels que en médecine lors des perfusions ou d'un œdème pulmonaire (Osmose inverse) , en biotechnologie , En chimie ( dessalement de l'eau de mer ) |
 Erreurs ou confusions éventuelles
Erreurs ou confusions éventuelles
- Confusion entre diffusion et dialyse
- Confusion entre perméabilité et osmose
- Erreur fréquente: L'osmose est un phénomène actif ( nécessitant de l'énergie)
ou passif
 Questions possibles
Questions possibles
 Liaisons enseignements et programmes
Liaisons enseignements et programmes
Idées ou Réflexions liées à son enseignement
Aides et astuces
{{Fiche Didactique Astuces-Enseignement |Astuces-Enseignement=
On pose la question suivante: Pourquoi on utilise une concentration de 9g/l en glucose ou en NaCl lors des perfusions. Projection de vidéos montrant les phénomènes de turgescences et de plasmolyse pour questionner et chercher leurs causes.
Education: Autres liens, sites ou portails
 Bibliographie
Bibliographie
Pour citer cette page: ([1])
ABROUGUI, M & al, 2021. Osmose. In Didaquest [en ligne]. <http:www.didaquest.org/wiki/Osmose>, consulté le 11, mai, 2025
- ..................
- ..................
- ..................
- ..................