Différences entre versions de « Osmose »
| Ligne 189 : | Ligne 189 : | ||
<!-- ****************** Commercez les modifications *************************--> | <!-- ****************** Commercez les modifications *************************--> | ||
* Confusion entre [[pression osmotique et pression hydrostatique]] | * Confusion entre [[pression osmotique et pression hydrostatique]] | ||
| + | * Confusion entre [[perméabilité et osmose]] | ||
| + | * Confusion entre [[turgescence et plasmolyse]] | ||
* Confusion entre [[diffusion et dialyse]] | * Confusion entre [[diffusion et dialyse]] | ||
| − | + | ||
| − | * | + | * Erreurs fréquentes: L'osmose est un phénomène actif ( nécessitant de l'énergie) ou passif |
| − | ou passif | + | L'osmose se fait seulement au sein de la cellule animale. |
| + | |||
| + | |||
}}<!-- ************** Fin Fiche Didactique Conceptions ********************* --> | }}<!-- ************** Fin Fiche Didactique Conceptions ********************* --> | ||
Version du 10 janvier 2021 à 15:01
 Traduction
Traduction
 Définition
Définition
Domaine, Discipline, Thématique
Définition écrite
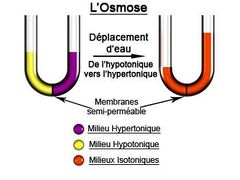
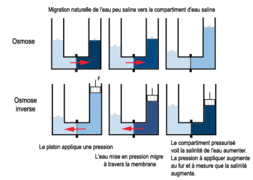
L'osmose est le passage de molécules de solvant, en général de l'eau, à travers une membrane semi-perméable (qui laisse passer uniquement l'eau), depuis le milieu le moins concentré (hypotonique) en solutés vers celui le plus concentré (hypertonique)==>(Diffusion de la matière) Ce phénomène s'arrête lorsque les deux liquides séparés par la membrane ont atteint la même concentration. On parle alors de milieux isotoniques. La pression hydrostatique due à la différence de hauteur d'eau entre ces deux milieux compense alors la pression osmotique. Cette notion a permis de mieux comprendre le comportement des solutions aqueuses en chimie, à la fin du XIXe siècle ; mais elle est aussi particulièrement utile en physiologie et en biologie cellulaire pour expliquer les échanges chimiques au sein des organismes vivants. Une différence de pression hydrostatique entre les deux liquides provoque un mouvement du solvant en sens inverse, jusqu'à ce que la pression osmotique soit aussi élevée que la pression hydrostatique. C'est le phénomène de l'osmose inverse.
Un peu d'Histoire
En 1748, l'abbé Nollet remarque que lorsque l'on sépare de l'eau et de l'alcool par une vessie animale, l'eau passe dans l'alcool mais jamais l'inverse1. Dans ses travaux sur les solutions aqueuses menés entre 1827 et 1832, René Dutrochet propose les termes « d'endosmose » et « d'exosmose » pour désigner ce phénomène. K. Vicrordt s'intéresse également à ce phénomène en 1848. En 1854, Thomas Graham travaille sur les substances colloïdes et découvre qu'elles ne peuvent pas passer à travers une membrane animale. C'est alors que le terme « osmose » a été créé en 1854 par ce chimiste écossais à partir du grec ὠσμός qui signifie « poussée »2.
C'est M. Traube, en 1864, qui conçoit la première membrane artificielle en ferrocyanure de cuivre Cu2Fe(CN)6. En 1877, Wilhelm Friedrich Philipp Pfeffer (1845-1920) fait précipiter le ferrocyanure de cuivre dans un matériau poreux, ce qui permet d'avoir une membrane avec une bonne résistance mécanique.
En 1884, de Vries travaille sur la plasmolyse et la turgescence des cellules végétales.
En 1886, van 't Hoff publie une analogie entre les solutions aqueuses et les gaz parfaits et applique la thermodynamique à l'osmose. Il établit une loi, similaire dans sa forme à la loi des gaz parfaits, et propose l'adjectif « semiperméable » pour désigner les membranes. Il reçoit le prix Nobel de chimie en 1901 pour ses travaux.
En 1899, A. Crum Brown utilise trois phases liquides (une solution aqueuse de nitrate de calcium saturée en phénol en bas, couche de phénol pur au milieu et une solution d'eau saturée en phénol en haut). Il remarque un phénomène d'osmose (l'eau passe de la phase du haut vers la phase du bas), la phase liquide du milieu jouant le rôle de membrane semiperméable. Il établit ainsi l'importance de la solubilité de l'espèce diffusante dans la membrane.
Entre 1901 et 1923, H. N. Morse et J. C. W. Frazer mènent un travail systématique de mesure de la perméabilité pour différents précipités gélatineux : des ferrocyanures et des phosphates d'uranyl, de fer, de zinc, de cadmium et de manganèse.
Pression osmotique
La pression osmotique se définit comme la pression minimale qu’il faut exercer pour empêcher le passage d’un solvant d’une solution moins concentrée à une solution plus concentrée au travers d’une membrane semi-perméable (membrane hémi-perméable). En biophysique, on distingue la pression oncotique qui correspond à la part de la pression osmotique due aux protéines. La pression osmotique se concrétise quand la part de la fraction molaire du solvant aqueux n'est pas égale à 1.
On pourrait imaginer que, dans la solution la plus concentrée, les molécules d'eau sont en moins grand nombre et que donc il y a égalisation de ce nombre de molécules d'eau de chaque part de la membrane. Mais cet effet est très minime. En fait, dans la solution la plus concentrée, les molécules d'eau (si le solvant est de l'eau) s'agglomèrent autour des molécules de soluté hydrophiles. Ces molécules accaparées ne traversent pas la membrane ; l'important c'est la différence de concentration de « l'eau libre ». Ainsi, l'eau libre se déplace à partir de la solution où la concentration d'eau libre est élevée vers la solution où la concentration d'eau libre est faible, jusqu'à ce que les concentrations soient égales. Mais au bout du compte, le résultat est toujours le même : le solvant se déplace vers la solution dont la concentration de soluté est la plus élevée3.
La pression osmotique est proportionnelle aux concentrations de soluté de part et d’autre de la membrane et de la température ; lorsque l’on est en présence de plusieurs solutés, il faut prendre en compte la totalité des solutés (à la manière d’un gaz composé, somme des pressions partielles).
La pression osmotique d'une solution idéale se calcule par une formule développée par van 't Hoff en 1886 et appliquant le deuxième principe de la thermodynamique.
Pression osmotique et pression hydrostatique
La pression osmotique est aussi une pression mécanique, exerçant une force sur la membrane. Si la différence de pression osmotique est très grande, cela peut entraîner la rupture de la membrane (cas de l’hémolyse).
À l’inverse, si l’on exerce une pression mécanique (hydrostatique), on peut forcer le passage d’espèces à travers la membrane. C’est ce qui arrive lors d’un œdème aigu du poumon, et c’est ce que l’on utilise dans l’osmose inverse. Ce phénomène est aussi observable sur les œufs des poissons d'aquarium qui peuvent éclater ou s'écraser selon la différence de pression osmotique de chaque côté de la membrane, la coquille.
L'osmose inverse est une technique de purification de l'eau ; c'est aussi une technique de dessalement (ou désalinisation) de l'eau de mer permettant la production d'eau douce.
L'osmose peut être utilisée pour fabriquer des pompes osmotiques microscopiques ; dans cette micro-pompe, la batterie est remplacée par une certaine quantité de sel. Ce sel étant plus concentré dans le dispositif qu'à l'extérieur, du fait de la pression osmotique il tend à sortir de son réservoir. Ce faisant le "courant de sortie" qu'il crée induit un courant d'entrée (c'est-à-dire un "pompage"). Ce système a été utilisée dans un micro-laboratoire de la taille d'une pilule, pouvant dans l'intestin prélever des échantillons de microbiote à des fins d'études.
Importance biologique et relation avec la cellule
Il existe, en biologie, trois types de relation osmotique : les relations hypotoniques, isotoniques, et hypertoniques.
Pour la cellule, la relation hypotonique correspond au moment où la concentration à l'intérieur de la cellule est supérieure à celle du milieu. La cellule va absorber du liquide extracellulaire, la pression interne augmente, et va éventuellement la faire exploser : c'est l'hémolyse.
La relation isotonique correspond au moment où la solution dans la cellule et celle du milieu sont équitablement concentrées, la taille de la cellule reste stable et ne fluctue pas.
La relation hypertonique correspond au moment où la solution dans la cellule est peu concentrée par rapport à celle du milieu, la cellule va libérer du liquide vers le milieu et la pression interne de la cellule diminue, la taille de la cellule va faire de même. Si trop de liquide est expulsé, la cellule va mourir par plasmolyse.
|
On met en évidence l'osmose par le passage de molécules ou d’ions à travers une membrane (perméable ou semi-perméable) qui sépare deux solutions de composition (ou de concentration) différente. Il faut que la membrane soit perméable à l'eau (ou au solvant de façon plus générale) et imperméable aux solutés (membranes semi-perméable parfaite, sélective ou dyalisante). Tant que les deux solutions ne contiennent pas le même nombre de particules dissoutes par unité de volume, on observe un déplacement de l'eau (ou du solvant) du compartiment le moins concentré (appelé milieu hypotonique) vers le compartiment le plus concentré (milieu hypertonique), qui tend à équilibrer les concentrations. L’osmose est à l’origine de la turgescence et la plasmolyse de la cellule végétale |
Définition graphique
 Concepts ou notions associés
Concepts ou notions associés
 Exemples, applications, utilisations
Exemples, applications, utilisations
|
Le principe d'osmose est appliqué dans plusieurs domaines tels que en médecine lors des perfusions ou d'un œdème pulmonaire (Osmose inverse) , en biotechnologie , En chimie ( dessalement de l'eau de mer ) |
 Erreurs ou confusions éventuelles
Erreurs ou confusions éventuelles
- Confusion entre pression osmotique et pression hydrostatique
- Confusion entre perméabilité et osmose
- Confusion entre turgescence et plasmolyse
- Confusion entre diffusion et dialyse
- Erreurs fréquentes: L'osmose est un phénomène actif ( nécessitant de l'énergie) ou passif
L'osmose se fait seulement au sein de la cellule animale.
 Questions possibles
Questions possibles
 Liaisons enseignements et programmes
Liaisons enseignements et programmes
Idées ou Réflexions liées à son enseignement
Aides et astuces
{{Fiche Didactique Astuces-Enseignement |Astuces-Enseignement=
On pose la question suivante: Pourquoi on utilise une concentration de 9g/l en glucose ou en NaCl lors des perfusions. Projection de vidéos montrant les phénomènes de turgescences et de plasmolyse pour questionner et chercher leurs causes.
Education: Autres liens, sites ou portails
 Bibliographie
Bibliographie
Pour citer cette page: ([1])
ABROUGUI, M & al, 2021. Osmose. In Didaquest [en ligne]. <http:www.didaquest.org/wiki/Osmose>, consulté le 24, novembre, 2024
- ..................
- ..................
- ..................
- ..................
- Sponsors Education
- Biologie (Concepts)
- Chimie (Concepts)
- Biochimie (Concepts)
- Botanique (Concepts)
- Hydrologie (Concepts)
- Biologie cellulaire (Concepts)
- Physiologie (Concepts)
- Pression osmotique
- Pression hydrostatique
- Perméabilité
- Concentration
- Plasmolyse
- Diffusion de la matière
- Isotonie
- Hypertonie
- Hypotonie
- Osmose inverse
- Turgescence
- Dialyse
- Diffusion
- Concepts
- Osmose
- Osmose (Concepts)
- Fiche conceptuelle didactique