Différences entre versions de « Réaction acido basique »
(Page créée avec « {{Widget:Fiche-Conceptuelle-Haut}} = {{Widget:Traduction-Fiche}} = <!-- ***********************************************************************--> <!-- *************** D... ») |
|||
| (50 versions intermédiaires par le même utilisateur non affichées) | |||
| Ligne 12 : | Ligne 12 : | ||
[[{{FULLPAGENAME}}]] (Français) | [[{{FULLPAGENAME}}]] (Français) | ||
| − | / [[ | + | / [[Acid–base reaction]] (Anglais) |
| − | / [[ | + | / [[التفاعل الحمضي-القاعدي]] (Arabe) |
| + | / [[Asit-baz tepkimesi]] (Turque) | ||
| + | / [[Säure-Base-Reaktion]] (Allemand) | ||
| + | / [[Кислотно-основные реакции]] (Russe) | ||
}}<!-- ************** Fin Fiche Didactique Traduction ********************* --> | }}<!-- ************** Fin Fiche Didactique Traduction ********************* --> | ||
| Ligne 26 : | Ligne 29 : | ||
<!--****************** Commercez les modifications: Fiche-Disciplines-Thématiques *********************--> | <!--****************** Commercez les modifications: Fiche-Disciplines-Thématiques *********************--> | ||
| − | |Domaine-Discipline-Thématique-1= | + | |Domaine-Discipline-Thématique-1= chimie |
| − | |Domaine-Discipline-Thématique-2= | + | |Domaine-Discipline-Thématique-2= biologie |
| − | |Domaine-Discipline-Thématique-3= | + | |Domaine-Discipline-Thématique-3= médecine |
| − | |Domaine-Discipline-Thématique-4= | + | |Domaine-Discipline-Thématique-4= industrie |
|Domaine-Discipline-Thématique-5= | |Domaine-Discipline-Thématique-5= | ||
|Domaine-Discipline-Thématique-6= | |Domaine-Discipline-Thématique-6= | ||
| Ligne 49 : | Ligne 52 : | ||
<!-- *************** Commercez les modifications *******************--> | <!-- *************** Commercez les modifications *******************--> | ||
| − | + | > Une ''réaction acido-basique'' est une réaction chimique au cours de laquelle se produit un transfert d'un ou plusieurs '''ions H+''' en solution aqueuse. Une réaction acido-basique met en jeu deux couples acide-base: le couple Acide1/Base1 et le couple Acide2/Base2. | |
| − | + | ||
| − | + | Pour équilibrer l'équation de la réaction qui a lieu entre les deux couples, on établit les demi-équations associées à chaque espèce chimique, puis on les additionne de façon à ne plus avoir de H+, c'est-à-dire obtenir autant d'ions du côté des réactifs que du côté des produits. L'espèce chimique qui capte ces ions est appelée base ; celle qui les cède, acide. | |
| − | + | ||
| − | + | Par convention un couple acide base s'écrit acide/base. Un couple acide base est lié par cet échange de proton H+ | |
| − | + | ||
| − | + | La demi-équation acido-basique s'écrit : AH = A- + H+ ou A- + H+ = AH, c'est-à-dire : acide = base + H+ ou base + H+ = acide | |
| + | |||
| + | Ou plus simplement soit A un acide, B une base et H le proton H+ perdu/gagné : B + AH = A +BH. | ||
| + | |||
| + | |||
| + | |||
| + | On dit aussi que AH est l'acide conjugué de A- ou, A- est la base conjuguée de AH. | ||
| + | |||
| + | |||
| + | |||
| + | Les acides et les bases peuvent être regroupés en couples acide/base. En effet, un acide perdant un proton H+ produit une espèce capable d'en capter un, appelée base conjuguée. | ||
| + | |||
| + | |||
| + | |||
| + | Suivant les réactions, certaines espèces chimiques peuvent se comporter comme des acides ou des bases, elles sont alors appelées ampholytes. Les ampholytes deviennent acide ou basique en fonction du réactif que l'on fait réagir avec. Si ce réactif est un acide, il deviendra basique et inversement. Exemple d'ampholyte : l'eau. | ||
| + | |||
| + | |||
| + | > Tous les couples acide-base s'écrivent sous la forme acide/base; par exemple : | ||
| + | ° ion hydronium / eau : H3O+ / H2O | ||
| + | ° eau / ion hydroxyde : H2O / HO– | ||
| + | ° acide éthanedioïque (acide oxalique) / ion hydrogénoxalate : C2O4H2 / HC2O4– | ||
| + | ° ion hydrogénoxalate / ion éthanedioate : HC2O4– / C2O42– | ||
| + | ° ion méthylammonium / méthylamine : CH3NH3+ / CH3NH2 | ||
| + | ° ion ammonium / ammoniac : NH4+ / NH3 | ||
| + | ° acide méthanoïque (formique) / ion méthanoate (ion formiate) : HCOOH / HCOO– | ||
| + | ° acide éthanoïque (acétique) / ion éthanoate (ion acétate) : CH3COOH(aq) / CH3COO–(aq) | ||
| + | |||
| + | |||
| + | |||
| + | |||
<!-- ******** Fin Définition Générale ***************************** --> | <!-- ******** Fin Définition Générale ***************************** --> | ||
| Ligne 62 : | Ligne 94 : | ||
|Typologie= <!------------------------------------ Ne pas Modifier --> | |Typologie= <!------------------------------------ Ne pas Modifier --> | ||
<!-- ****************** Commercez les modifications ****************--> | <!-- ****************** Commercez les modifications ****************--> | ||
| − | + | ||
| − | + | > '''Différentes théories''' : | |
| − | .. | + | |
| − | + | ||
| − | + | -''Théorie d'Arrhénius'' | |
| − | + | ||
| − | + | → Un acide est capable de se dissocier en libérant des ions H+ (protons) en solution aqueuse. En réalité, les protons H+ libres ne sont pas présents en solution, mais se lient à des molécules d'eau pour former des ions oxonium H3O+. | |
| + | |||
| + | → Une base quand à elle est capable de capter un ou plusieurs protons H+ et libérer un ion hydroxyde, OH-. | ||
| + | |||
| + | |||
| + | -''Théorie Brønsted-Lowry'' | ||
| + | |||
| + | → Un acide c'est toute espèce chimique capable de céder un ou plusieurs protons H+, c'est-à-dire d'en perdre un . | ||
| + | |||
| + | → Par contre une base c'est une espèce chimique capable de capter un ou plusieurs protons H+. | ||
| + | |||
| + | Pour cette théorie, les acides sont reconnaissables en solution aqueuse par un pH inférieur à 7 et les bases par un pH supérieur à 7. | ||
| + | |||
| + | |||
| + | -''Théorie de Lewis'' | ||
| + | |||
| + | →Un acide est une espèce chimique qui peut capter une paire d'électrons libérée par une autre espèce chimique en solution aqueuse. C'est ce qui le caractérise. C'est un récepteur d'électrons, on dit qu'il est électrophile. | ||
| + | |||
| + | →Une base est toute espèce qui possède une paire d'électrons non-liante et qui peut offrir une paire d'électrons à une autre espèce chimique lors d'une réaction. C'est donc un donneur d'électrons, et il est dit nucléophile. | ||
| + | |||
| + | |||
| + | avec ; | ||
| + | ''Électrophile'' : composé chimique attiré par les espèces chimiques chargées négativement | ||
| + | |||
| + | ''Nucléophile'' :composé chimique attiré par les espèces chargées positivement | ||
| + | |||
| + | |||
| + | '''Remarque:''' | ||
| + | |||
| + | La théorie de Brønsted sur les acides et des bases est très ressemblante à celle de Lewis. Le modèle des acides et des bases de Lewis fait intervenir un électrophile. On peut parler de l'interaction acide-base comme d'un cas particulier de l'interaction électrophile/nucléophile du modèle de Lewis. | ||
| + | |||
| + | |||
| + | |||
| + | |||
}}<!-- ******** Fin Fiche Didactique Définition ******************* --> | }}<!-- ******** Fin Fiche Didactique Définition ******************* --> | ||
| Ligne 83 : | Ligne 148 : | ||
<!-- Remplacez, Adaptez, Ajoutez ou Supprimez les images et lignes non utilisées--> | <!-- Remplacez, Adaptez, Ajoutez ou Supprimez les images et lignes non utilisées--> | ||
| − | Image: | + | Image:Réaction+acido-basique.jpg|Réaction acido basique |
| − | Image: | + | Image:Acido_basique.jpg|des demi-equations |
| − | Image: | + | Image:39.aut1.jpg|exemple |
| + | Image:14820.gif|reaction aside base | ||
| + | Image:Réaction_(acide-base)_acide_carbox-alcoolate.gif|Réaction entre l'acide carboxique et l'ion alcoolate | ||
| + | |||
</gallery><!-- ************** Fin modification images***************************--> | </gallery><!-- ************** Fin modification images***************************--> | ||
| Ligne 96 : | Ligne 164 : | ||
<!-- ****************** Commercez les modifications pour les Vidéos *******************************************************--> | <!-- ****************** Commercez les modifications pour les Vidéos *******************************************************--> | ||
| − | <youtube width="220" height="220"> | + | '''*Les acides et les bases*''' |
| − | <youtube width="220" height="220"> | + | |
| − | <youtube width="220" height="220"> | + | <youtube width="220" height="220">jyZoCaDKV7k</youtube> |
| + | |||
| + | |||
| + | '''*La réaction acido-basique (selon la théorie de brönstedt )*''' | ||
| + | |||
| + | <youtube width="220" height="220">gicX8K7Aiuo</youtube> | ||
| + | |||
| + | |||
| + | '''*Calculer le pH d'une base faible & d'un acide faible*''' | ||
| + | |||
| + | <youtube width="220" height="220">556BUn2S-zM</youtube> | ||
| + | |||
| + | |||
| + | '''*Calculer le pH d'une base forte & d'un acide fort*''' | ||
| + | |||
| + | <youtube width="220" height="220">hiyaXlT-YBY</youtube> | ||
| + | |||
| + | |||
| + | |||
}}<!-- ************************* Fin modifications pour les Médias *******************************************************--> | }}<!-- ************************* Fin modifications pour les Médias *******************************************************--> | ||
| Ligne 111 : | Ligne 197 : | ||
<!----------------- Commencez les modifications des Mots Clés ---------------------> | <!----------------- Commencez les modifications des Mots Clés ---------------------> | ||
| − | |Mot-Clé-1= | + | |Mot-Clé-1= acide |
| − | |Mot-Clé-2= | + | |Mot-Clé-2= base |
| − | |Mot-Clé-3= | + | |Mot-Clé-3= réaction chimique |
| − | |Mot-Clé-4= | + | |Mot-Clé-4= équation chimique |
| − | |Mot-Clé-5= | + | |Mot-Clé-5= pH |
| − | |Mot-Clé-6= | + | |Mot-Clé-6= couple acide/base |
| − | |Mot-Clé-7= | + | |Mot-Clé-7= ampholyte |
|Mot-Clé-8= | |Mot-Clé-8= | ||
|Mot-Clé-9= | |Mot-Clé-9= | ||
| Ligne 123 : | Ligne 209 : | ||
}}<!-- ********************* FIN Fiche Didactique Mots-clés *******************--> | }}<!-- ********************* FIN Fiche Didactique Mots-clés *******************--> | ||
| − | |||
= {{Widget:Exemples-applications-utilisations-Fiche}} = | = {{Widget:Exemples-applications-utilisations-Fiche}} = | ||
| Ligne 135 : | Ligne 220 : | ||
<!-- ****************** Commercez les modifications *********************** --> | <!-- ****************** Commercez les modifications *********************** --> | ||
| − | *. | + | *Exemple : réaction entre l'acide éthanoïque (couple CH3COOH/CH3COO−) et l'ion hydroxyde (couple H2O/HO−). |
| − | + | ||
| − | + | '''Demi-équation du couple A1/B1''' : | |
| − | + | CH3COOH(aq) = CH3COO−(aq) + H+ | |
| + | |||
| + | '''Demi-équation du couple A2/B'''2 (inversée) : | ||
| + | HO−(aq) + H+ = H2O(l) | ||
| + | |||
| + | '''Équation de la réaction acido-basique''' : | ||
| + | CH3COOH(aq) + HO−(aq) → CH3COO−(aq) + H2O(l) | ||
| + | |||
| + | *'''Les acides forts''': l'acide chlorhydrique HCl; l'acide nitrique HNO3; l'acide sulfurique H2SO4 | ||
| + | *'''Les acides faibles''': acide méthanoïque; acide carboxylique | ||
| + | |||
*............................................................................... | *............................................................................... | ||
................................................................................ | ................................................................................ | ||
| Ligne 144 : | Ligne 239 : | ||
................................................................................ | ................................................................................ | ||
}}<!--************** Fin Fiche Didactique Explicitations ******************* --> | }}<!--************** Fin Fiche Didactique Explicitations ******************* --> | ||
| − | |||
= {{Widget:Erreurs-confusions-Fiche}} = | = {{Widget:Erreurs-confusions-Fiche}} = | ||
| Ligne 156 : | Ligne 250 : | ||
<!-- ****************** Commercez les modifications *************************--> | <!-- ****************** Commercez les modifications *************************--> | ||
| − | * Confusion entre [[ | + | * Confusion entre [[une réaction chimique et une transformation physique]] |
| − | * Confusion entre [[ | + | * Confusion entre [[acide et base]] |
| − | * Erreur fréquente: | + | * Confusion entre [[acide fort et acide faibe]] |
| + | * Confusion entre [[équation bilan et demi-équation]] | ||
| + | |||
| + | * Erreur fréquente: ° Conception péjorative des acides sur la santé | ||
| + | ° Les acides sont plus dangereux que les bases | ||
}}<!-- ************** Fin Fiche Didactique Conceptions ********************* --> | }}<!-- ************** Fin Fiche Didactique Conceptions ********************* --> | ||
| − | |||
= {{Widget:Questions-possibles-Fiche}} = | = {{Widget:Questions-possibles-Fiche}} = | ||
| Ligne 172 : | Ligne 269 : | ||
<!-- ************ Commercez les modifications *********************--> | <!-- ************ Commercez les modifications *********************--> | ||
| − | * [[ | + | * [[Comment justifier qu'une réaction est Acido-basique ? ]] |
| − | * [[ | + | * [[Qu'est-ce qu'un couple Acido-basique ?]] |
| − | * [[ | + | * [[Quel est le pH d'une solution acide ?]] |
| + | * [[C'est quoi une base ?]] | ||
| + | * [[Quels sont les acides forts ?]] | ||
| + | * [[Quelle est la base la plus forte ?]] | ||
}}<!-- ******** Fin Fiche Didactique Questions ******************* --> | }}<!-- ******** Fin Fiche Didactique Questions ******************* --> | ||
| − | |||
= {{Widget:Liens-enseignement-Fiche}} = | = {{Widget:Liens-enseignement-Fiche}} = | ||
| Ligne 208 : | Ligne 307 : | ||
<!-- ****************** Commercez les modifications ************************** --> | <!-- ****************** Commercez les modifications ************************** --> | ||
| − | * . | + | * Le couple Acide/Base est de la forme : |
| − | :* | + | '''AH / A−''' |
| − | * .. | + | |
| − | :* | + | La demi-équation Acide/Base correspondante est : |
| + | |||
| + | '''AH <=> A− + H+''' | ||
| + | :* Une espèce à la fois base conjuguée d'un couple et acide conjugué d'un autre est appelée '''ampholyte''' ou '''amphotère''' : elle peut réagir comme une base ou comme un acide. | ||
| + | exemple : | ||
| + | * H3O+/ H2O(l) : dans ce couple l’eau est une base H3O+ = H2O(l) + H+ | ||
| + | *H2O / HO-(aq) : dans ce couple l’eau est un acide H2O = HO-(aq) + H+ | ||
| + | => L'eau peut être un acide ou une base. On dit que ''l’eau'' est un '''ampholyte''' ou une espèce '''amphotère'''. | ||
| + | |||
| + | :*Il y a équivalence acido-basique lorsque le nombre de moles d’ions H3O+ fournis par | ||
| + | l’acide est égal au nombre de moles d’ions OH- fournis par la base. | ||
}}<!-- ************************* Fin Astuces-Enseignement ********************** --> | }}<!-- ************************* Fin Astuces-Enseignement ********************** --> | ||
| Ligne 223 : | Ligne 332 : | ||
<!-- ****************** Commercez les modifications ************--> | <!-- ****************** Commercez les modifications ************--> | ||
| − | :* .... | + | :* https://www.lachimie.net/index.php?page=43#.XeQ49pNKjIU |
| − | :* .. | + | :* https://www.futura-sciences.com/sciences/definitions/chimie-reaction-acido-basique-14972/ |
:* .................. | :* .................. | ||
Version actuelle datée du 3 janvier 2020 à 00:43
 Traduction
Traduction
Réaction acido basique (Français)
/ Acid–base reaction (Anglais)
/ التفاعل الحمضي-القاعدي (Arabe)
/ Asit-baz tepkimesi (Turque)
/ Säure-Base-Reaktion (Allemand)
/ Кислотно-основные реакции (Russe)
 Définition
Définition
Domaine, Discipline, Thématique
Définition écrite
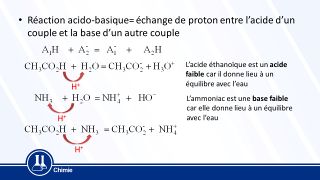
> Une réaction acido-basique est une réaction chimique au cours de laquelle se produit un transfert d'un ou plusieurs ions H+ en solution aqueuse. Une réaction acido-basique met en jeu deux couples acide-base: le couple Acide1/Base1 et le couple Acide2/Base2.
Pour équilibrer l'équation de la réaction qui a lieu entre les deux couples, on établit les demi-équations associées à chaque espèce chimique, puis on les additionne de façon à ne plus avoir de H+, c'est-à-dire obtenir autant d'ions du côté des réactifs que du côté des produits. L'espèce chimique qui capte ces ions est appelée base ; celle qui les cède, acide.
Par convention un couple acide base s'écrit acide/base. Un couple acide base est lié par cet échange de proton H+
La demi-équation acido-basique s'écrit : AH = A- + H+ ou A- + H+ = AH, c'est-à-dire : acide = base + H+ ou base + H+ = acide
Ou plus simplement soit A un acide, B une base et H le proton H+ perdu/gagné : B + AH = A +BH.
On dit aussi que AH est l'acide conjugué de A- ou, A- est la base conjuguée de AH.
Les acides et les bases peuvent être regroupés en couples acide/base. En effet, un acide perdant un proton H+ produit une espèce capable d'en capter un, appelée base conjuguée.
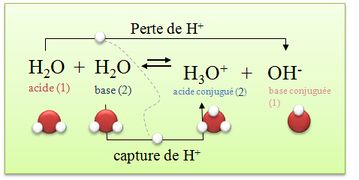
Suivant les réactions, certaines espèces chimiques peuvent se comporter comme des acides ou des bases, elles sont alors appelées ampholytes. Les ampholytes deviennent acide ou basique en fonction du réactif que l'on fait réagir avec. Si ce réactif est un acide, il deviendra basique et inversement. Exemple d'ampholyte : l'eau.
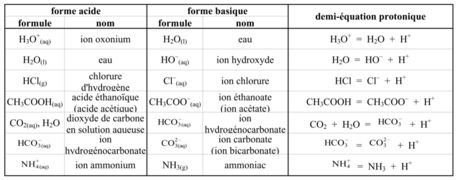
> Tous les couples acide-base s'écrivent sous la forme acide/base; par exemple :
° ion hydronium / eau : H3O+ / H2O ° eau / ion hydroxyde : H2O / HO– ° acide éthanedioïque (acide oxalique) / ion hydrogénoxalate : C2O4H2 / HC2O4– ° ion hydrogénoxalate / ion éthanedioate : HC2O4– / C2O42– ° ion méthylammonium / méthylamine : CH3NH3+ / CH3NH2 ° ion ammonium / ammoniac : NH4+ / NH3 ° acide méthanoïque (formique) / ion méthanoate (ion formiate) : HCOOH / HCOO– ° acide éthanoïque (acétique) / ion éthanoate (ion acétate) : CH3COOH(aq) / CH3COO–(aq)
|
> Différentes théories :
-Théorie d'Arrhénius → Un acide est capable de se dissocier en libérant des ions H+ (protons) en solution aqueuse. En réalité, les protons H+ libres ne sont pas présents en solution, mais se lient à des molécules d'eau pour former des ions oxonium H3O+. → Une base quand à elle est capable de capter un ou plusieurs protons H+ et libérer un ion hydroxyde, OH-.
-Théorie Brønsted-Lowry → Un acide c'est toute espèce chimique capable de céder un ou plusieurs protons H+, c'est-à-dire d'en perdre un . → Par contre une base c'est une espèce chimique capable de capter un ou plusieurs protons H+. Pour cette théorie, les acides sont reconnaissables en solution aqueuse par un pH inférieur à 7 et les bases par un pH supérieur à 7.
-Théorie de Lewis →Un acide est une espèce chimique qui peut capter une paire d'électrons libérée par une autre espèce chimique en solution aqueuse. C'est ce qui le caractérise. C'est un récepteur d'électrons, on dit qu'il est électrophile. →Une base est toute espèce qui possède une paire d'électrons non-liante et qui peut offrir une paire d'électrons à une autre espèce chimique lors d'une réaction. C'est donc un donneur d'électrons, et il est dit nucléophile.
Nucléophile :composé chimique attiré par les espèces chargées positivement
La théorie de Brønsted sur les acides et des bases est très ressemblante à celle de Lewis. Le modèle des acides et des bases de Lewis fait intervenir un électrophile. On peut parler de l'interaction acide-base comme d'un cas particulier de l'interaction électrophile/nucléophile du modèle de Lewis. |
Définition graphique
 Concepts ou notions associés
Concepts ou notions associés
 Exemples, applications, utilisations
Exemples, applications, utilisations
Demi-équation du couple A1/B1 : CH3COOH(aq) = CH3COO−(aq) + H+ Demi-équation du couple A2/B2 (inversée) : HO−(aq) + H+ = H2O(l) Équation de la réaction acido-basique : CH3COOH(aq) + HO−(aq) → CH3COO−(aq) + H2O(l)
................................................................................ ................................................................................ ................................................................................ |
 Erreurs ou confusions éventuelles
Erreurs ou confusions éventuelles
- Confusion entre une réaction chimique et une transformation physique
- Confusion entre acide et base
- Confusion entre acide fort et acide faibe
- Confusion entre équation bilan et demi-équation
- Erreur fréquente: ° Conception péjorative des acides sur la santé
° Les acides sont plus dangereux que les bases
 Questions possibles
Questions possibles
 Liaisons enseignements et programmes
Liaisons enseignements et programmes
Idées ou Réflexions liées à son enseignement
Aides et astuces
- Le couple Acide/Base est de la forme :
AH / A−
La demi-équation Acide/Base correspondante est :
AH <=> A− + H+
- Une espèce à la fois base conjuguée d'un couple et acide conjugué d'un autre est appelée ampholyte ou amphotère : elle peut réagir comme une base ou comme un acide.
exemple :
* H3O+/ H2O(l) : dans ce couple l’eau est une base H3O+ = H2O(l) + H+
*H2O / HO-(aq) : dans ce couple l’eau est un acide H2O = HO-(aq) + H+
=> L'eau peut être un acide ou une base. On dit que l’eau est un ampholyte ou une espèce amphotère.
- Il y a équivalence acido-basique lorsque le nombre de moles d’ions H3O+ fournis par
l’acide est égal au nombre de moles d’ions OH- fournis par la base.
Education: Autres liens, sites ou portails
 Bibliographie
Bibliographie
Pour citer cette page: (acido basique)
ABROUGUI, M & al, 2020. Réaction acido basique. In Didaquest [en ligne]. <http:www.didaquest.org/wiki/R%C3%A9action_acido_basique>, consulté le 19, mai, 2024
- ..................
- ..................
- ..................
- ..................