Solution acide
De Didaquest
Aller à la navigationAller à la recherche
 Traduction
Traduction
Solution acide (Français) / acid solution (Anglais) / محلول حمض (Arabe)
 Définition
Définition
- Domaine, Discipline, Thématique :
Catégorie: SVT / Catégorie: Chimie
Définition écrite
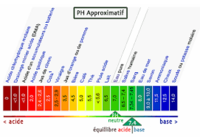
Un acide est une substance qui en solution aqueuse, libère un ou plusieurs protons (H+). Ayant une valeur de PH inférieure à 7 et donne une couleur jaune avec quelque gouttes de BBT (Bleu de bromothymol).
Toute les solutions aqueuses (ainsi que l’eau supposée pure) contiennent des ions hydroxyde de formule OH- et des ions hydrogène de formule H+. Ces ions sont produits naturellement par une transformation chimique qui a lieu entre les molécules d’eau. Lorsqu'une solution est neutre il y a autant de d’ions hydroxyde que d’ions hydrogène. Les ions hydrogène sont responsables de l’acidité d’une solution : lorsqu’ils sont plus nombreux que les ions hydroxyde la solution est acide. Inversement les ions hydroxyde sont responsables du caractère basique (basicité) d’une solution: lorsqu’ils sont plus nombreux que les ions hydrogène la solution est basique. |
Définition graphique
 Concepts ou notions associés
Concepts ou notions associés
|
|
 Exemples, applications, utilisations
Exemples, applications, utilisations
- Le fer en solution chlorhydrique est réduit à l'état ferreux par une solution de chlorure
stanneux : 2 Fe3+ + Sn2+ → 2 Fe2+ + Sn4+
L'excès de chlorure stanneux est éliminé par addition de chlorure mercurique, le
chlorure mercureux précipite : SnCl2 + 2 HgCl2 → Hg2Cl2 + SnCl4
Les ions ferreux sont dosés en milieu sulfurique - chlorhydrique par une solution de
permanganate de potassium titrée : 2 KMnO4 + 3H2SO4 + 10 FeCl2 + 10 HCl → 2 MnSO4 + K2SO4 + 10 FeCl3 + 8 H2O
Le réactif de Zimmerman - Reinhart contenant du sulfate de manganèse, de l'acide sulfurique et de l'acide phosphorique est utilisé pour éviter l'oxydation de l'acide chlorhydrique et supprimer la coloration jaune du chlorure ferrique formé, gênante pour la détection de la fin de la réaction.
- la compréhension des réactions en solution aqueuse, en mettant l’accent en particulier sur les réactions acido-basiques et les réactions d’oxydo-réduction, s’inscrit dans le domaine de la « chimie analytique », discipline se situant à la base de tout domaine faisant intervenir des analyses qualitatives et/ou quantitatives. Les connaissances et les outils acquis au cours de cet enseignement seront utilisés dans un grand nombre de domaines comme la microbiologie, la biochimie, l’enzymologie, la toxicologie et de la sécurité alimentaire, la biologie et bien entendu la chimie.
 Erreurs ou confusions éventuelles
Erreurs ou confusions éventuelles
- Les élèves peuvent confondre entre les trois types de solution possibles:Acide-Basique-Neutre
 Questions possibles
Questions possibles
- Question:
Identifier les solutions acides en utilisant soit PH-mètre, papier PH, BBT Ecrire l’équation associée à la dissociation de la molécule de X
 Liaisons enseignements et programmes
Liaisons enseignements et programmes
- Portail Formation Gratuite
- Multisites Educatifs
- Sur DidaQuest
- Sur le Portail Didactique.info
- Sur le Portail Questions / Réponses
- Concept Sur Wikipedia
- Concept Sur Wikiwand
- Concept Sur Wikiversity
 Aides, Astuces,...
Aides, Astuces,...
- Utiliser des solutions divers et identifier ce qui sont acides avec le papier PH ou PH-mètre ou bien BBT
- Faire un dosage acido-basique
=
 Difficultés liées à son enseignement =
Difficultés liées à son enseignement =
* Déterminer le point d’équivalence au cours du dosage d’un acide
 Liens Internet
Liens Internet
- URL : http://www.lachimie.net/index.php?page=42
- URL : http://uel.unisciel.fr/chimie/solutaque/solutaque_ch04/co/apprendre_ch4_01.html