Différences entre versions de « Acide faible - acide fort »
De Didaquest
Aller à la navigationAller à la recherche| (18 versions intermédiaires par le même utilisateur non affichées) | |||
| Ligne 58 : | Ligne 58 : | ||
<!----*** Commencez les modifications Conceptions-ou-Concepts liés ***-----> | <!----*** Commencez les modifications Conceptions-ou-Concepts liés ***-----> | ||
| − | |Concept-lié-1= ''' | + | |Concept-lié-1= '''La force de 2 acides faibles A1H et A2H de même concentration''' |
| − | + | |Concept-lié-2= '''le coefficient le dissociation a''' | |
| − | + | |Concept-lié-3= '''La constante pKa''' | |
| − | + | |Concept-lié-4= '''L'échelle du pH''' | |
| − | l'acide | + | |Concept-lié-5= '''La dilution''' |
| − | + | |Concept-lié-6= '''La concentration de l'acide''' | |
| − | |||
| − | |||
| − | |||
}}<!-- ****************** FIN Concepts liés aux conceptions ************--> | }}<!-- ****************** FIN Concepts liés aux conceptions ************--> | ||
| Ligne 81 : | Ligne 78 : | ||
<!-- Remplacez, Adaptez, Ajoutez ou Supprimez les images et lignes non utilisées--> | <!-- Remplacez, Adaptez, Ajoutez ou Supprimez les images et lignes non utilisées--> | ||
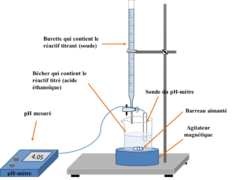
| − | Image: | + | Image:montage_titrage acido-basique - Ca inconnue.png|montage_titrage acido-basique |
| − | |||
| − | |||
</gallery><!-- ************** Fin modification images***************************--> | </gallery><!-- ************** Fin modification images***************************--> | ||
| Ligne 94 : | Ligne 89 : | ||
<!-- ****************** Commercez les modifications pour les Vidéos *******************************************************--> | <!-- ****************** Commercez les modifications pour les Vidéos *******************************************************--> | ||
| − | <youtube width="220" height="220"> | + | <youtube width="220" height="220">https://www.youtube.com/watch?v=2WXEqpwHB7Q&feature=emb_logo</youtube> vidéo sur l'échelle de pH |
| − | + | ||
| − | <youtube width="220" height="220"> | + | <youtube width="220" height="220">https://www.youtube.com/watch?v=haVvuorO9iE</youtube> Dosage d'un acide suivi par pHmétrie. |
}}<!-- ************************* Fin modifications pour les Médias *******************************************************--> | }}<!-- ************************* Fin modifications pour les Médias *******************************************************--> | ||
| − | |||
= {{Widget:Stratégie de changement conceptuelle : Solutions possibles}} = | = {{Widget:Stratégie de changement conceptuelle : Solutions possibles}} = | ||
| Ligne 126 : | Ligne 120 : | ||
<!-- ************ Commercez les modifications *********************--> | <!-- ************ Commercez les modifications *********************--> | ||
| − | * [[ | + | * [[Comment déterminer la concentration inconnue d'une solution acide ?]] |
| − | + | ||
| − | |||
}}<!-- ******** Fin Fiche Didactique Questions ******************* --> | }}<!-- ******** Fin Fiche Didactique Questions ******************* --> | ||
| Ligne 140 : | Ligne 133 : | ||
<!-- ****************** Commercez les modifications *********************--> | <!-- ****************** Commercez les modifications *********************--> | ||
| − | * .. | + | * acides bases - exercice - Terminale ST2S - MOOC#1 [[https://www.youtube.com/watch?v=tF40PBrSpN4]] |
| − | |||
| − | |||
| − | |||
}}<!-- ************* Fin Fiche Didactique Bibliographie *************** --> | }}<!-- ************* Fin Fiche Didactique Bibliographie *************** --> | ||
{{Widget:Fiche-Conceptions-Bas}} | {{Widget:Fiche-Conceptions-Bas}} | ||
Version actuelle datée du 4 janvier 2020 à 08:16
 Conception : Clarification - Explicitation
Conception : Clarification - Explicitation
- l'acide le plus fort possède la valeur du pH la plus petite
Pour un acide fort : Si Ca représente la concentration de l'acide alors [H3O+]=Ca donc pH = - log Ca Pour un acide faible : Si Ca représente la concentration de l'acide alors [H3O+]<Ca donc pH > - log Ca De plus :
Pour un acide fort : Le coefficient de dissociation a , sera : a = [H3O+] /Ca = 1 Pour un acide faible : Le coefficient de dissociation a , sera : a= [H3O+] /Ca < 1 et a augmente quand Ca diminue On peut conclure :
Pour un acide fort : La réaction avec l'eau est totale: AH + H2O →H3O+ + A- Pour un acide faible : La réaction avec l'eau n'est pas totale: AH + H2O<=>H3O+ + A-
![]() Conceptions erronées et origines possibles
Conceptions erronées et origines possibles
- l'acide le plus fort possède la valeur du pH la plus grande
![]() Conceptions: Origines possibles
Conceptions: Origines possibles
- Si l'individu ne connait pas l'échelle du pH alors ne sais plus le sens de l’acidité croissante donc ne peut pas faire une comparaison juste de deux acides
 Conceptions liées - Typologie
Conceptions liées - Typologie
 Concepts ou notions associés
Concepts ou notions associés
 Éléments graphique
Éléments graphique
 Stratégie de changement conceptuel
Stratégie de changement conceptuel
 Questions possibles
Questions possibles
 Bibliographie
Bibliographie
Pour citer cette page: (faible - acide fort)
ABROUGUI, M & al, 2020. Acide faible - acide fort. In Didaquest [en ligne]. <http:www.didaquest.org/wiki/Acide_faible_-_acide_fort>, consulté le 28, novembre, 2024
- acides bases - exercice - Terminale ST2S - MOOC#1 [[1]]
Catégories :
- Sponsors Question
- Erreur liée aux opérations intellectuelles impliquées - Conceptions
- Erreur causée par la complexité du contenu - Conceptions
- Erreur portant sur les démarches adoptées - Conceptions
- Conceptions
- '''La force de 2 acides faibles A1H et A2H de même concentration''' - Conceptions
- '''le coefficient le dissociation a''' - Conceptions
- '''La constante pKa''' - Conceptions
- '''L'échelle du pH''' - Conceptions
- '''La dilution''' - Conceptions
- '''La concentration de l'acide''' - Conceptions
- Fiches Conceptions
- Fiche Conceptions