Osmose
 Traduction
Traduction
 Définition
Définition
Domaine, Discipline, Thématique
Définition écrite
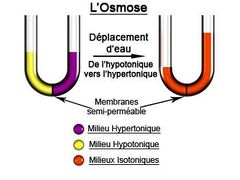
L'osmose est le passage de molécules de solvant, en général de l'eau, à travers une membrane semi-perméable (qui laisse passer uniquement l'eau), depuis le milieu le moins concentré (hypotonique) en solutés vers celui le plus concentré (hypertonique)==>(Diffusion de la matière) Ce phénomène s'arrête lorsque les deux liquides séparés par la membrane ont atteint la même concentration. On parle alors de milieux isotoniques. La pression hydrostatique due à la différence de hauteur d'eau entre ces deux milieux compense alors la pression osmotique. Cette notion a permis de mieux comprendre le comportement des solutions aqueuses en chimie, à la fin du XIXe siècle ; mais elle est aussi particulièrement utile en physiologie et en biologie cellulaire pour expliquer les échanges chimiques au sein des organismes vivants. Une différence de pression hydrostatique entre les deux liquides provoque un mouvement du solvant en sens inverse, jusqu'à ce que la pression osmotique soit aussi élevée que la pression hydrostatique. C'est le phénomène de l'osmose inverse.
Un peu d'Histoire
En 1748, l'abbé Nollet remarque que lorsque l'on sépare de l'eau et de l'alcool par une vessie animale, l'eau passe dans l'alcool mais jamais l'inverse1. Dans ses travaux sur les solutions aqueuses menés entre 1827 et 1832, René Dutrochet propose les termes « d'endosmose » et « d'exosmose » pour désigner ce phénomène. K. Vicrordt s'intéresse également à ce phénomène en 1848. En 1854, Thomas Graham travaille sur les substances colloïdes et découvre qu'elles ne peuvent pas passer à travers une membrane animale. C'est alors que le terme « osmose » a été créé en 1854 par ce chimiste écossais à partir du grec ὠσμός qui signifie « poussée »2.
C'est M. Traube, en 1864, qui conçoit la première membrane artificielle en ferrocyanure de cuivre Cu2Fe(CN)6. En 1877, Wilhelm Friedrich Philipp Pfeffer (1845-1920) fait précipiter le ferrocyanure de cuivre dans un matériau poreux, ce qui permet d'avoir une membrane avec une bonne résistance mécanique.
En 1884, de Vries travaille sur la plasmolyse et la turgescence des cellules végétales.
En 1886, van 't Hoff publie une analogie entre les solutions aqueuses et les gaz parfaits et applique la thermodynamique à l'osmose. Il établit une loi, similaire dans sa forme à la loi des gaz parfaits, et propose l'adjectif « semiperméable » pour désigner les membranes. Il reçoit le prix Nobel de chimie en 1901 pour ses travaux.
En 1899, A. Crum Brown utilise trois phases liquides (une solution aqueuse de nitrate de calcium saturée en phénol en bas, couche de phénol pur au milieu et une solution d'eau saturée en phénol en haut). Il remarque un phénomène d'osmose (l'eau passe de la phase du haut vers la phase du bas), la phase liquide du milieu jouant le rôle de membrane semiperméable. Il établit ainsi l'importance de la solubilité de l'espèce diffusante dans la membrane.
Entre 1901 et 1923, H. N. Morse et J. C. W. Frazer mènent un travail systématique de mesure de la perméabilité pour différents précipités gélatineux : des ferrocyanures et des phosphates d'uranyl, de fer, de zinc, de cadmium et de manganèse. L'osmose fut découverte par Dutrochet (1826) qui imagina un appareil (osmomètre) constitué d'un réservoir de verre, sorte de cylindre vertical dont la base est obturée par une membrane hémiperméable (vessie de porc) et dont la partie supérieure est reliée à un long tube vertical de petit calibre. Si ce récipient est rempli d'une solution sucrée colorée et plongé dans un cristallisoir contenant de l'eau, les deux concentrations, interne et externe, ont tendance à s'égaliser, mais comme seule l'eau peut franchir la membrane, les échanges se réduisent à une entrée d'eau dans l'osmomètre, et le liquide monte dans le tube. Tout se passe comme si les molécules de sucre attiraient l'eau extérieure. Le mouvement se poursuit jusqu'à ce que la pression hydrostatique créée par la dénivellation dans le tube équilibre l'attraction exercée sur l'eau par la solution. Cette pression est dite pression osmotique (p.o.) de la solution. Plus elle est élevée, plus l'attraction exercée sur l'eau est grande. Deux solutions de p.o. égales sont dites isotoniques ; mises de part et d'autre d'une membrane hémiperméable, elles donnent lieu à aucun échange d'eau. Quand une solution a une p.o. plus élevée qu'une autre, elle est dite hypertonique par rapport à la seconde, celle-ci étant hypotonique par rapport à la première. L'osmose est un cas particulier de la diffusion, mouvement spontané des particules d'un système qui tend à homogénéiser les potentiels chimiques des constituants dans les différentes parties. Quand deux solutions sont séparées par une membrane hémiperméable, le potentiel chimique de l'eau est plus bas dans la solution hypertonique que dans l'autre, d'où l'attraction exercée. Le traitement thermodynamique d'un tel système conduit à la loi de Van't Hoff : π = NRT, où π est la p.o. ; N, le nombre de particules libres, osmotiquement actives, par unité de volume ; R, la constante des gaz parfaits ; T L'osmose fut découverte par Dutrochet (1826) qui imagina un appareil (osmomètre) constitué d'un réservoir de verre, sorte de cylindre vertical dont la base est obturée par une membrane hémiperméable (vessie de porc) et dont la partie supérieure est reliée à un long tube vertical de petit calibre. Si ce récipient est rempli d'une solution sucrée colorée et plongé dans un cristallisoir contenant de l'eau, les deux concentrations, interne et externe, ont tendance à s'égaliser, mais comme seule l'eau peut franchir la membrane, les échanges se réduisent à une entrée d'eau dans l'osmomètre, et le liquide monte dans le tube. Tout se passe comme si les molécules de sucre attiraient l'eau extérieure. Le mouvement se poursuit jusqu'à ce que la pression hydrostatique créée par la dénivellation dans le tube équilibre l'attraction exercée sur l'eau par la solution. Cette pression est dite pression osmotique (p.o.) de la solution. Plus elle est élevée, plus l'attraction exercée sur l'eau est grande. Deux solutions de p.o. égales sont dites isotoniques ; mises de part et d'autre d'une membrane hémiperméable, elles donnent lieu à aucun échange d'eau. Quand une solution a une p.o. plus élevée qu'une autre, elle est dite hypertonique par rapport à la seconde, celle-ci étant hypotonique par rapport à la première. L'osmose est un cas particulier de la diffusion, mouvement spontané des particules d'un système qui tend à homogénéiser les potentiels chimiques des constituants dans les différentes parties. Quand deux solutions sont séparées par une membrane hémiperméable, le potentiel chimique de l'eau est plus bas dans la solution hypertonique que dans l'autre, d'où l'attraction exercée. Le traitement thermodynamique d'un tel système conduit à la loi de Van't Hoff : π = NRT, où π est la p.o. ; N, le nombre de particules libres, osmotiquement actives, par unité de volume ; R, la constante des gaz parfaits ; T
Pression osmotique
La pression osmotique se définit comme la pression minimale qu’il faut exercer pour empêcher le passage d’un solvant d’une solution moins concentrée à une solution plus concentrée au travers d’une membrane semi-perméable (membrane hémi-perméable). En biophysique, on distingue la pression oncotique qui correspond à la part de la pression osmotique due aux protéines. La pression osmotique se concrétise quand la part de la fraction molaire du solvant aqueux n'est pas égale à 1.
On pourrait imaginer que, dans la solution la plus concentrée, les molécules d'eau sont en moins grand nombre et que donc il y a égalisation de ce nombre de molécules d'eau de chaque part de la membrane. Mais cet effet est très minime. En fait, dans la solution la plus concentrée, les molécules d'eau (si le solvant est de l'eau) s'agglomèrent autour des molécules de soluté hydrophiles. Ces molécules accaparées ne traversent pas la membrane ; l'important c'est la différence de concentration de « l'eau libre ». Ainsi, l'eau libre se déplace à partir de la solution où la concentration d'eau libre est élevée vers la solution où la concentration d'eau libre est faible, jusqu'à ce que les concentrations soient égales. Mais au bout du compte, le résultat est toujours le même : le solvant se déplace vers la solution dont la concentration de soluté est la plus élevée3.
La pression osmotique est proportionnelle aux concentrations de soluté de part et d’autre de la membrane et de la température ; lorsque l’on est en présence de plusieurs solutés, il faut prendre en compte la totalité des solutés (à la manière d’un gaz composé, somme des pressions partielles).
La pression osmotique d'une solution idéale se calcule par une formule développée par van 't Hoff en 1886 et appliquant le deuxième principe de la thermodynamique.
Pression osmotique et pression hydrostatique
La pression osmotique est aussi une pression mécanique, exerçant une force sur la membrane. Si la différence de pression osmotique est très grande, cela peut entraîner la rupture de la membrane (cas de l’hémolyse).
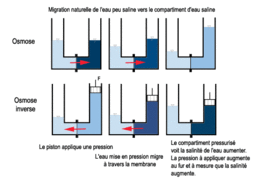
À l’inverse, si l’on exerce une pression mécanique (hydrostatique), on peut forcer le passage d’espèces à travers la membrane. C’est ce qui arrive lors d’un œdème aigu du poumon, et c’est ce que l’on utilise dans l’osmose inverse. Ce phénomène est aussi observable sur les œufs des poissons d'aquarium qui peuvent éclater ou s'écraser selon la différence de pression osmotique de chaque côté de la membrane, la coquille.
L'osmose inverse est une technique de purification de l'eau ; c'est aussi une technique de dessalement (ou désalinisation) de l'eau de mer permettant la production d'eau douce.
L'osmose peut être utilisée pour fabriquer des pompes osmotiques microscopiques ; dans cette micro-pompe, la batterie est remplacée par une certaine quantité de sel. Ce sel étant plus concentré dans le dispositif qu'à l'extérieur, du fait de la pression osmotique il tend à sortir de son réservoir. Ce faisant le "courant de sortie" qu'il crée induit un courant d'entrée (c'est-à-dire un "pompage"). Ce système a été utilisée dans un micro-laboratoire de la taille d'une pilule, pouvant dans l'intestin prélever des échantillons de microbiote à des fins d'études.
Importance biologique et relation avec la cellule
Il existe, en biologie, trois types de relation osmotique : les relations hypotoniques, isotoniques, et hypertoniques.
Pour la cellule, la relation hypotonique correspond au moment où la concentration à l'intérieur de la cellule est supérieure à celle du milieu. La cellule va absorber du liquide extracellulaire, la pression interne augmente, et va éventuellement la faire exploser : c'est l'hémolyse.
La relation isotonique correspond au moment où la solution dans la cellule et celle du milieu sont équitablement concentrées, la taille de la cellule reste stable et ne fluctue pas.
La relation hypertonique correspond au moment où la solution dans la cellule est peu concentrée par rapport à celle du milieu, la cellule va libérer du liquide vers le milieu et la pression interne de la cellule diminue, la taille de la cellule va faire de même. Si trop de liquide est expulsé, la cellule va mourir par plasmolyse.
|
On met en évidence l'osmose par le passage de molécules ou d’ions à travers une membrane (perméable ou semi-perméable) qui sépare deux solutions de composition (ou de concentration) différente. Il faut que la membrane soit perméable à l'eau (ou au solvant de façon plus générale) et imperméable aux solutés (membranes semi-perméable parfaite, sélective ou dyalisante). Tant que les deux solutions ne contiennent pas le même nombre de particules dissoutes par unité de volume, on observe un déplacement de l'eau (ou du solvant) du compartiment le moins concentré (appelé milieu hypotonique) vers le compartiment le plus concentré (milieu hypertonique), qui tend à équilibrer les concentrations. L’osmose est à l’origine de la turgescence et la plasmolyse de la cellule végétale |
Définition graphique
 Concepts ou notions associés
Concepts ou notions associés
Perméabilité / Diffusion / Pression osmotique / Membrane semi-perméable / Solutions hypertonique, hypotonique, et isotonique / Équilibre osmotique / Potentiel hydrique / Plasmolyse / Turgescence / Gradient de concentration / Osmorégulation / Phénomène colligatif / Transport actif / Endosmose / Exosmose / Équilibre hydrique / Assimilation osmotique / Plante halophyte / Animal osmoconformeur / Poïkilotherme / Pression hydrostatique / Concentration / Osmose inverse / Dialyse / Transport membranaire / Osmolalité / Résistance osmotique / Solution hypertonique / Solution hypotonique / Équilibre osmotique / Potentiel hydrique / Phénomène colligatif / Transport actif / Endosmose / Exosmose / Équilibre hydrique / Assimilation osmotique / Plante halophyte / Animal osmoconformeur / Poïkilotherme / Gradient de concentration / Phénomène d'osmolarité / Osmose cellulaire / Équation de Van't Hoff / Coefficient de réflexion / Loi de Starling / Colloïde / Pression oncotique / Membrane sélectivement perméable / Filtration glomérulaire / Échangeur ionique / Loi de Fick / État colloïdal / Soluté / Solvant / Semi-perméabilité / Réabsorption / Sécrétion / Aquaporine / Réflexion osmotique / Hyperosmolaire / Hypo-osmolaire / Osmométrie / Éléments osmotiques / Osmophiles / Régulation osmotique / Pression osmotique effective / Loi de Boyle-van't Hoff / Coligand / Cotransport / Contre-transport / Perméabilité sélective / Équation de Gibbs-Donnan / Équilibre électro-osmotique / Fraction molaire / Loi de Raoult / Solution colligative / Cryoscopie / Osmorégulateur / Osmolalité plasmatique / Osmorégulation marine / Osmotrophie / Plasmoptysie / Diurèse osmotique / Antidiurèse / Osmose intracellulaire / Osmose extracellulaire / Échange osmotique / Thérapie osmotique / Osmotique corporelle / Osmotique cérébrale / Osmotique sanguine / Pression osmotique plasmatique / Osmoconcentration / Osmoregulation rénale / Osmoregulation hépatique / Osmoregulation pulmonaire / Osmorégulation intestinale / Osmorégulation cutanée / Osmorégulation pulmonaire /
 Exemples, applications, utilisations
Exemples, applications, utilisations
lors des perfusions ou d'un œdème pulmonaire (Osmose inverse). Osmose, « maladie » du polyester Le terme osmose est utilisé pour désigner la formation de bulles sous le gelcoat, revêtement en polyester des coques de bateaux, et des piscines. Longtemps considéré comme un défaut de fabrication, il semble que d'infimes particules de cobalt, excitées par de faibles courant électriques, dus à de mauvaises masses, se colorent d'un brun rougeâtre, tout en provoquant une rupture plus ou moins importante, dans l'étanchéité intrinsèque du matériau polyester. De nos jours, des recherches - toujours en développement démontrent que si les courants faibles, et la présence de particules de cobalt, ainsi qu'une mauvaise hygrométrie lors de l'application des résines, peuvent aggraver ou déclencher ce phénomène d'osmose, ces facteurs ne permettent pas d'en expliquer l'absence, sur d'autres revêtements polyester pourtant exposés aux mêmes traitements. À ce jour, s'il est devenu possible d'expliquer comment l'osmose prend naissance, il n'est toujours pas possible d'expliquer pourquoi certains revêtements sont attaqués et d'autres pas.
Peroxydes « frelatés » En fait la raison est à chercher au niveau des solvants utilisés pour diluer les peroxydes (catalyseurs). L'un des producteurs de peroxyde a eu la malencontreuse idée d'employer des solvants dérivés de l'éthylène glycol qui sont non volatils et solubles dans l'eau. Les résines polyester ainsi catalysées contenaient donc des solvants miscibles à l'eau. La quantité finale de solvants était faible mais au fil du temps l'eau était absorbée et provoquait des cloques. Ces cloques apparaissaient parce qu'il y avait une couche de résine réellement imperméable (soit pas de solvants miscibles à l'eau). Le phénomène a été assez long à se déclarer et être compris pour que le producteur de peroxydes ait le temps de participer à la construction d'un grand nombre de bateaux. Comme c'est un seul producteur qui était concerné cela explique que tous les bateaux n'aient pas été concernés. Les sels de cobalt qui sont des activateurs des peroxydes, ne sont pas directement concernés : ce sont des sels d'acides organiques (genre octoate de cobalt) et ils ne sont pas solubles dans l'eau. |
 Erreurs ou confusions éventuelles
Erreurs ou confusions éventuelles
- Confusion entre pression osmotique et pression hydrostatique
- Confusion entre perméabilité et osmose
- Confusion entre turgescence et plasmolyse
- Confusion entre diffusion et dialyse
- Erreurs fréquentes: L'osmose est un phénomène actif ( nécessitant de l'énergie) ou passif
L'osmose se fait seulement au sein de la cellule animale.
 Questions possibles
Questions possibles
 Liaisons enseignements et programmes
Liaisons enseignements et programmes
Idées ou Réflexions liées à son enseignement
Aides et astuces
{{Fiche Didactique Astuces-Enseignement |Astuces-Enseignement=
On pose la question suivante: Pourquoi on utilise une concentration de 9g/l en glucose ou en NaCl lors des perfusions. Projection de vidéos montrant les phénomènes de turgescences et de plasmolyse pour questionner et chercher leurs causes.
Education: Autres liens, sites ou portails
 Bibliographie
Bibliographie
Pour citer cette page: ([1])
ABROUGUI, M & al, 2024. Osmose. In Didaquest [en ligne]. <http:www.didaquest.org/wiki/Osmose>, consulté le 28, novembre, 2024
- ..................
- ..................
- ..................
- ..................
- Sponsors Education
- Biologie (Concepts)
- Chimie (Concepts)
- Biochimie (Concepts)
- Botanique (Concepts)
- Hydrologie (Concepts)
- Biologie cellulaire (Concepts)
- Physiologie (Concepts)
- Perméabilité
- Diffusion
- Pression osmotique
- Membrane semi-perméable
- Solutions hypertonique, hypotonique, et isotonique
- Équilibre osmotique
- Potentiel hydrique
- Plasmolyse
- Turgescence
- Gradient de concentration
- Osmorégulation
- Phénomène colligatif
- Transport actif
- Endosmose
- Exosmose
- Équilibre hydrique
- Assimilation osmotique
- Plante halophyte
- Animal osmoconformeur
- Poïkilotherme
- Pression hydrostatique
- Concentration
- Osmose inverse
- Dialyse
- Transport membranaire
- Osmolalité
- Résistance osmotique
- Solution hypertonique
- Solution hypotonique
- Phénomène d'osmolarité
- Osmose cellulaire
- Équation de Van't Hoff
- Coefficient de réflexion
- Loi de Starling
- Colloïde
- Pression oncotique
- Membrane sélectivement perméable
- Filtration glomérulaire
- Échangeur ionique
- Loi de Fick
- État colloïdal
- Soluté
- Solvant
- Semi-perméabilité
- Réabsorption
- Sécrétion
- Aquaporine
- Réflexion osmotique
- Hyperosmolaire
- Hypo-osmolaire
- Osmométrie
- Éléments osmotiques
- Osmophiles
- Régulation osmotique
- Pression osmotique effective
- Loi de Boyle-van't Hoff
- Coligand
- Cotransport
- Contre-transport
- Perméabilité sélective
- Équation de Gibbs-Donnan
- Équilibre électro-osmotique
- Fraction molaire
- Loi de Raoult
- Solution colligative
- Cryoscopie
- Osmorégulateur
- Osmolalité plasmatique
- Osmorégulation marine
- Osmotrophie
- Plasmoptysie
- Diurèse osmotique
- Antidiurèse
- Osmose intracellulaire
- Osmose extracellulaire
- Échange osmotique
- Thérapie osmotique
- Osmotique corporelle
- Osmotique cérébrale
- Osmotique sanguine
- Pression osmotique plasmatique
- Osmoconcentration
- Osmoregulation rénale
- Osmoregulation hépatique
- Osmoregulation pulmonaire
- Osmorégulation intestinale
- Osmorégulation cutanée
- Osmorégulation pulmonaire
- Concepts
- Osmose
- Osmose (Concepts)
- Fiche conceptuelle didactique