Différences entre versions de « Solution en chimie »
De Didaquest
Aller à la navigationAller à la recherche| (22 versions intermédiaires par 2 utilisateurs non affichées) | |||
| Ligne 11 : | Ligne 11 : | ||
<!-- ****************** Commercez les modifications ************************--> | <!-- ****************** Commercez les modifications ************************--> | ||
| − | [[ | + | [[solution]] (Français) |
/ [[solution]] (Anglais) | / [[solution]] (Anglais) | ||
/ [[محلول ]] (Arabe) | / [[محلول ]] (Arabe) | ||
| Ligne 49 : | Ligne 49 : | ||
<!-- *************** Commercez les modifications *******************--> | <!-- *************** Commercez les modifications *******************--> | ||
| − | *Mélange liquide homogène d'une ou plusieurs substance(s) solide(s), liquide(s) ou gazeuse(s), le soluté, et d'un liquide, le solvant. | + | * Mélange liquide homogène d'une ou plusieurs substance(s) solide(s), liquide(s) ou gazeuse(s), le soluté, et d'un liquide, le solvant. |
| − | *On appelle solution un mélange constitué d'un solvant, l'espèce majoritaire, et d'un ou plusieurs solutés, les espèces minoritaires placées dans le solvant. | + | |
| + | * Qu’est-ce qu’un mélange ? | ||
| + | C'est l'opération qui consiste à réunir plusieurs composants, à les mêler. Un ensemble ainsi constitué peut être: | ||
| + | :- hétérogène : on voit des substances en suspension ou en dépôt (ex. : eau + farine), ou | ||
| + | : - homogène : on ne distingue plus les différents constituants. | ||
| + | :: Ex.: mélange homogène solide (farine + plâtre), | ||
| + | :: Ex.: mélange homogène liquide (eau + alcool), | ||
| + | :: Ex.: mélange homogène gazeux (air). | ||
| + | |||
| + | * On appelle solution un mélange constitué d'un solvant, l'espèce majoritaire, et d'un ou plusieurs solutés, les espèces minoritaires placées dans le solvant. | ||
| + | * Le soluté peut être à l’état solide, liquide ou gazeux et il se dissout dans le solvant. La solution obtenue (mélange homogène du soluté et du solvant) peut être solide ou liquide (en pratique on ne parle pas de solution pour un mélange homogène de gaz) | ||
| + | |||
| + | |||
<!-- ******** Fin Définition Générale ***************************** --> | <!-- ******** Fin Définition Générale ***************************** --> | ||
<!-- ************* Début Définition Approfondissement ************* --> | <!-- ************* Début Définition Approfondissement ************* --> | ||
| Ligne 56 : | Ligne 68 : | ||
|Typologie= <!------------------------------------ Ne pas Modifier --> | |Typologie= <!------------------------------------ Ne pas Modifier --> | ||
<!-- ****************** Commercez les modifications ****************--> | <!-- ****************** Commercez les modifications ****************--> | ||
| − | + | * Une solution, c'est avant tout un mélange. Plus précisément, un mélange homogène liquide (eau et sel ou eau et sucre) ou solide (alliage). Dans ce mélange, l'un des composants joue un rôle différent des autres. Si on prend le cas d'une solution d'eau sucrée, l'eau est ce que l'on appelle le [[solvant]] (en plus grande quantité) et le sucre le [[soluté]]. Dans ces mélanges homogènes, on ne peut distinguer le [[soluté]]. | |
| − | + | ||
| − | + | * Toute solution dont l'eau constitue le solvant est qualifiée de solution aqueuse. | |
| − | Solution solide de substitution. Système où les atomes dissous se substituent aux atomes solvants, le système cristallin du produit de base étant conservé. L'alliage est stable aux températures élevées sous la forme d'une solution solide de substitution désordonnée; aux basses températures, il se trouve sous une forme ordonnée qui peut être considérée comme un composé défini (Encyclop. univ.t. 11968, p. 776). | + | L'[[eau]] est un excellent [[solvant]], un des meilleurs solvants naturels. Le [[soluté]] peut être liquide (eau et vin !), solide (eau salée) ou gazeux (eau gazeuse). L'opération ainsi réalisée s'appelle une [[dissolution]]. |
| − | Solution solide d'insertion, d'addition. Système où les atomes dissous occupent les interstices du réseau cristallin du produit de base. Dans le cas des solutions solides d'addition, les atomes subtitués occupent des positions interstitielles dans le réseau de l'hôte. Ces solutions solides sont fréquentes dans les phyllosilicates et tectosilicates: minéraux des argiles et zéolites (Encyclop. univ.t. 111971, p. 49). | + | * Solution: - mélange liquide ou solide |
| − | + | :- mélange homogène (= dont on ne peut distinguer les différents constituants) - constituée d'un solvant (en plus grande quantité) et d'un ou plusieurs solutés sous forme solide, liquide ou gazeuse | |
| − | + | :- on ne peut séparer le soluté du solvant ni par filtration, ni par décantation | |
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | * [[Solution colloïdale]]. Solution dans laquelle le solvant est un liquide et le soluté un solide disséminé de manière homogène sous forme de très fines particules, la préparation étant soit un sol, soit un gel. Synon. suspension; anton. solution vraie.Les solutions colloïdales sont formées d'une suspension de fines particules (granules ou micelles) (Gasnier,Dépôts métall., 1927, p. 185). | |
| − | + | * [[Solution vraie]]. Solution dans laquelle le ou les soluté(s) sont à l'état de division moléculaire dans le solvant. Synon. cour. solution; anton. solution colloïdale.Ces produits sont transportés dans l'air à l'état solide, et, dans l'eau, à l'état de suspensions, de solutions colloïdales ou de solutions vraies (Brajnikov,Pétrogr. et rayons X, 1936, p. 9). | |
| − | + | * [[Solution solide]]. Mélange de plusieurs corps extrêmement visqueux intervenant dans la formation de certains alliages et de certains composés minéraux qui, après solidification, offre une structure parfaitement homogène. Synon. syncristallisation.Mais, de fait, cela n'est pas si simple, à cause de la formation d'une « solution solide » du radium dans le précipité gélatineux (J. Chim. Phys., 1905, p. 619). | |
| + | ** [[Solution solide de substitution]]. Système où les atomes dissous se substituent aux atomes solvants, le système cristallin du produit de base étant conservé. L'alliage est stable aux températures élevées sous la forme d'une solution solide de substitution désordonnée; aux basses températures, il se trouve sous une forme ordonnée qui peut être considérée comme un composé défini (Encyclop. univ.t. 11968, p. 776). | ||
| + | ** [[Solution solide d'insertion]], d'addition. Système où les atomes dissous occupent les interstices du réseau cristallin du produit de base. Dans le cas des solutions solides d'addition, les atomes subtitués occupent des positions interstitielles dans le réseau de l'hôte. Ces solutions solides sont fréquentes dans les phyllosilicates et tectosilicates: minéraux des argiles et zéolites (Encyclop. univ.t. 111971, p. 49). | ||
| + | |||
| + | : '''Solutions de titre ou de dosage particulier''' | ||
| + | * [[Solution saturée]]. Solution contenant autant de soluté que le solvant peut en dissoudre pour arriver à la limite de saturation. Le polissage terminé, on attaque la surface traitée par des solutions acides (...). On emploie également l'acide picrique en solution saturée dans cet alcool | ||
| + | * [[Solution normale]]. Solution contenant une valence-gramme (poids atomique divisé par la valence du corps) de substance dissoute par litre. Dans la solution de ce résidu on dosait le chlore par comparaison avec une solution normale | ||
| + | * [[Solution molaire]]. Solution contenant une molécule-gramme de substance dissoute par litre. La solution molaire est équivalente à la solution normale lorsque les ions formés par dissociation de la molécule de substance dissoute n'ont qu'une charge électropositive et une charge électronégative | ||
| + | * [[Solution standard]]. Solution contenant une quantité déterminée d'une ou plusieurs substances dissoutes. Les colorimètres étaient employés pour comparer la couleur de certains échantillons avec celle de solutions standard | ||
| + | * [[Solution idéale]]. Solution dont les constituants ont un poids moléculaire normal et qui se mélangent sans dégagement de chaleur, sans changement de volume et sans altération chimique. Dès 1875, Gibbs avait introduit la notion de « potentiel chimique » (...). Or, pour un gaz parfait, ou une solution idéale, ce potentiel chimique peut se calculer | ||
| + | * [[Solution-tampon]]. Solution dont l'acidité ou l'alcalinité demeure inchangée après dilution ou ajout d'acide ou de base, servant à doser le PH d'un milieu par comparaison ou à régler celui-ci par addition de cette solution. Solutions-tampons commodément préparables avec une teneur pratiquement constante en électrolytes | ||
| + | * [[Solution extractive]]. Solution préparée à partir d'un corps incomplètement soluble dans le dissolvant utilisé, servant à séparer un corps entre deux dissolvants ou pour extraire une substance active à partir de végétaux | ||
}}<!-- ******** Fin Fiche Didactique Définition ******************* --> | }}<!-- ******** Fin Fiche Didactique Définition ******************* --> | ||
| Ligne 83 : | Ligne 106 : | ||
<!-- Remplacez, Adaptez, Ajoutez ou Supprimez les images et lignes non utilisées--> | <!-- Remplacez, Adaptez, Ajoutez ou Supprimez les images et lignes non utilisées--> | ||
| − | Image: | + | Image:Mélange-chimique-solution-images_csp9583788.jpg|solution 1 |
| − | Image: | + | Image:Proton_ds_eau.gif|protons dans l'eau |
| − | Image: | + | Image:03580411_phychi1_ch01-018-i0301_contain_780.jpg|solution |
</gallery><!-- ************** Fin modification images***************************--> | </gallery><!-- ************** Fin modification images***************************--> | ||
| Ligne 96 : | Ligne 119 : | ||
<!-- ****************** Commercez les modifications pour les Vidéos *******************************************************--> | <!-- ****************** Commercez les modifications pour les Vidéos *******************************************************--> | ||
| − | <youtube width="220" height="220"> | + | <youtube width="220" height="220">cdYi12qjxQ4</youtube> |
| − | <youtube width="220" height="220"> | + | <youtube width="220" height="220">1JSCUhlu77s</youtube> |
| − | <youtube width="220" height="220"> | + | <youtube width="220" height="220">cxactxSUy24</youtube> |
}}<!-- ************************* Fin modifications pour les Médias *******************************************************--> | }}<!-- ************************* Fin modifications pour les Médias *******************************************************--> | ||
| Ligne 111 : | Ligne 134 : | ||
<!----------------- Commencez les modifications des Mots Clés ---------------------> | <!----------------- Commencez les modifications des Mots Clés ---------------------> | ||
| − | |Mot-Clé-1= | + | |Mot-Clé-1= Solvant |
| − | |Mot-Clé-2= | + | |Mot-Clé-2= Soluté |
| − | |Mot-Clé-3= | + | |Mot-Clé-3= Force ionique |
| − | |Mot-Clé-4= | + | |Mot-Clé-4= Dissolution |
| − | |Mot-Clé-5= | + | |Mot-Clé-5= Concentration |
|Mot-Clé-6= | |Mot-Clé-6= | ||
|Mot-Clé-7= | |Mot-Clé-7= | ||
| Ligne 123 : | Ligne 146 : | ||
}}<!-- ********************* FIN Fiche Didactique Mots-clés *******************--> | }}<!-- ********************* FIN Fiche Didactique Mots-clés *******************--> | ||
| − | |||
= {{Widget:Exemples-applications-utilisations-Fiche}} = | = {{Widget:Exemples-applications-utilisations-Fiche}} = | ||
| Ligne 135 : | Ligne 157 : | ||
<!-- ****************** Commercez les modifications *********************** --> | <!-- ****************** Commercez les modifications *********************** --> | ||
| − | * | + | * '''Exemples "Soluté / Solvant"''' |
| − | + | : Un verre de grenadine : Soluté = sirop (liquide) et Solvant = eau (liquide) | |
| − | + | : Un verre de soda : Soluté = dioxyde de carbone CO2 (gaz) et Solvant = eau (liquide) | |
| − | + | : Un verre d’eau sucrée (ou salée) : Soluté = sucre en poudre (solide) et Solvant = eau (liquide) | |
| − | * | + | |
| − | . | + | * '''Exemple: "Conservation de masse"''' |
| − | + | : Lorsque l'on mélange différents constituants d'une solution, la masse totale de ce mélange est égale à la somme des masses du solvant et du (ou des) soluté(s). C'est ce qu'on appelle la conservation de masse. | |
| − | + | : Exemple : pour une solution de 50 g de sel dans un litre d'eau, la masse de la solution est de 50 g (sel) + 1 kg (eau) = 1,050 kg (solution d'eau salée). | |
| + | |||
}}<!--************** Fin Fiche Didactique Explicitations ******************* --> | }}<!--************** Fin Fiche Didactique Explicitations ******************* --> | ||
| − | |||
= {{Widget:Erreurs-confusions-Fiche}} = | = {{Widget:Erreurs-confusions-Fiche}} = | ||
| Ligne 155 : | Ligne 177 : | ||
<!-- Compléter les pointillés et Supprimer les lignes non utilisées------------> | <!-- Compléter les pointillés et Supprimer les lignes non utilisées------------> | ||
<!-- ****************** Commercez les modifications *************************--> | <!-- ****************** Commercez les modifications *************************--> | ||
| + | * Confusion entre [[Solution - Mélange hétérogène]] | ||
| + | * Confusion entre [[Solution - Solution aqueuse]] | ||
| + | * Confusion entre [[Solution - Réaction chimique]] | ||
| + | * Confusion entre [[Solution - Mélange]] | ||
| + | * Confusion entre [[Solution - Dissolution]] | ||
| + | * Confusion entre [[Eau limpide - Eau pure - Eau potable]] | ||
| − | + | ||
| − | + | * Erreur fréquente: Une solution est toujours à l'état liquide or, Le soluté peut être à l’état solide, liquide ou gazeux et il se dissout dans le solvant. La solution obtenue (mélange homogène du soluté et du solvant) peut être solide ou liquide (en pratique on ne parle pas de solution pour un mélange homogène de gaz).Solution solide. Mélange de plusieurs corps extrêmement visqueux intervenant dans la formation de certains alliages et de certains composés minéraux qui, après solidification, offre une structure parfaitement homogène. | |
| − | * Erreur fréquente: ... | ||
}}<!-- ************** Fin Fiche Didactique Conceptions ********************* --> | }}<!-- ************** Fin Fiche Didactique Conceptions ********************* --> | ||
| − | |||
= {{Widget:Questions-possibles-Fiche}} = | = {{Widget:Questions-possibles-Fiche}} = | ||
| Ligne 172 : | Ligne 198 : | ||
<!-- ************ Commercez les modifications *********************--> | <!-- ************ Commercez les modifications *********************--> | ||
| − | * [[ | + | * [[Qu'est ce qu'une solution saturée ?]] |
| − | * [[ | + | * [[Comment le soluté se mélange-t-il au solvant ?]] |
* [[.................. ?]] | * [[.................. ?]] | ||
}}<!-- ******** Fin Fiche Didactique Questions ******************* --> | }}<!-- ******** Fin Fiche Didactique Questions ******************* --> | ||
| − | |||
= {{Widget:Liens-enseignement-Fiche}} = | = {{Widget:Liens-enseignement-Fiche}} = | ||
| Ligne 223 : | Ligne 248 : | ||
<!-- ****************** Commercez les modifications ************--> | <!-- ****************** Commercez les modifications ************--> | ||
| − | :* ... | + | :* http://gwenaelm.free.fr/Physique/Physchim/c02/Chimie/C11-Solutions.pdf |
| − | :* .. | + | :* http://keepschool.com/fiches-de-cours/lycee/chimie/solutions-acqueuses.html |
| − | :* .. | + | :* https://www.maxicours.com/se/cours/solutions-solvant-solutes-moleculaires-et-ioniques/ |
}}<!-- ************ Fin Liens Education ********************** --> | }}<!-- ************ Fin Liens Education ********************** --> | ||
Version actuelle datée du 9 février 2020 à 13:50
 Traduction
Traduction
 Définition
Définition
Domaine, Discipline, Thématique
Définition écrite
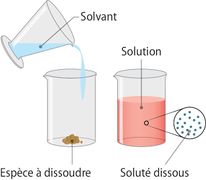
- Mélange liquide homogène d'une ou plusieurs substance(s) solide(s), liquide(s) ou gazeuse(s), le soluté, et d'un liquide, le solvant.
- Qu’est-ce qu’un mélange ?
C'est l'opération qui consiste à réunir plusieurs composants, à les mêler. Un ensemble ainsi constitué peut être:
- - hétérogène : on voit des substances en suspension ou en dépôt (ex. : eau + farine), ou
- - homogène : on ne distingue plus les différents constituants.
- Ex.: mélange homogène solide (farine + plâtre),
- Ex.: mélange homogène liquide (eau + alcool),
- Ex.: mélange homogène gazeux (air).
- On appelle solution un mélange constitué d'un solvant, l'espèce majoritaire, et d'un ou plusieurs solutés, les espèces minoritaires placées dans le solvant.
- Le soluté peut être à l’état solide, liquide ou gazeux et il se dissout dans le solvant. La solution obtenue (mélange homogène du soluté et du solvant) peut être solide ou liquide (en pratique on ne parle pas de solution pour un mélange homogène de gaz)
L'eau est un excellent solvant, un des meilleurs solvants naturels. Le soluté peut être liquide (eau et vin !), solide (eau salée) ou gazeux (eau gazeuse). L'opération ainsi réalisée s'appelle une dissolution.
|
Définition graphique
 Concepts ou notions associés
Concepts ou notions associés
 Exemples, applications, utilisations
Exemples, applications, utilisations
|
 Erreurs ou confusions éventuelles
Erreurs ou confusions éventuelles
- Confusion entre Solution - Mélange hétérogène
- Confusion entre Solution - Solution aqueuse
- Confusion entre Solution - Réaction chimique
- Confusion entre Solution - Mélange
- Confusion entre Solution - Dissolution
- Confusion entre Eau limpide - Eau pure - Eau potable
- Erreur fréquente: Une solution est toujours à l'état liquide or, Le soluté peut être à l’état solide, liquide ou gazeux et il se dissout dans le solvant. La solution obtenue (mélange homogène du soluté et du solvant) peut être solide ou liquide (en pratique on ne parle pas de solution pour un mélange homogène de gaz).Solution solide. Mélange de plusieurs corps extrêmement visqueux intervenant dans la formation de certains alliages et de certains composés minéraux qui, après solidification, offre une structure parfaitement homogène.
 Questions possibles
Questions possibles
 Liaisons enseignements et programmes
Liaisons enseignements et programmes
Idées ou Réflexions liées à son enseignement
Aides et astuces
Education: Autres liens, sites ou portails
 Bibliographie
Bibliographie
Pour citer cette page: (en chimie)
ABROUGUI, M & al, 2020. Solution en chimie. In Didaquest [en ligne]. <http:www.didaquest.org/wiki/Solution_en_chimie>, consulté le 18, mai, 2024
- ..................
- ..................
- ..................
- ..................