Différences entre versions de « Osmose »
| (10 versions intermédiaires par le même utilisateur non affichées) | |||
| Ligne 100 : | Ligne 100 : | ||
|Définition= <!-- Ne pas Modifier --> | |Définition= <!-- Ne pas Modifier --> | ||
<!-- *************** Commercez les modifications *******************--> | <!-- *************** Commercez les modifications *******************--> | ||
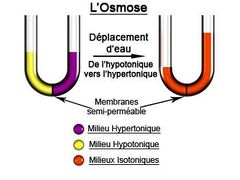
| + | L'osmose est un phénomène physico-chimique fondamental où des molécules de solvant, principalement de l'eau, traversent une membrane semi-perméable en réponse à une différence de concentration de solutés, conduisant à la création d'une pression osmotique. Ce processus, essentiel en chimie, physiologie et biologie cellulaire, implique un mouvement passif du solvant de la zone de moindre concentration (milieu hypotonique) vers la zone de plus grande concentration (milieu hypertonique), atteignant un état d'équilibre osmotique dans des milieux isotoniques. L'osmose régule des mécanismes biologiques tels que l'absorption cellulaire et le maintien de l'équilibre osmotique, permettant aux organismes de s'adapter aux variations environnementales. En tant que concept central, l'osmose éclaire la compréhension des processus complexes de transport passif et de régulation osmotique dans les systèmes biologiques. | ||
| + | |||
| + | |||
| + | |||
| + | |||
| + | <!-- ******** Fin Définition Générale ***************************** --> | ||
| + | <!-- ************* Début Définition Approfondissement ************* --> | ||
| + | <!-- Approfondissement des définitions à travers des classifications, des catégorisations, des typologies, ou autre.... --> | ||
| + | |Typologie= <!------------------------------------ Ne pas Modifier --> | ||
| + | <!-- ****************** Commercez les modifications ****************--> | ||
| + | |||
* '''Définition de base''' : | * '''Définition de base''' : | ||
L'osmose est un phénomène naturel où des molécules de solvant, habituellement de l'eau, se déplacent à travers une membrane semi-perméable d'une zone de concentration plus faible vers une zone de concentration plus élevée, sans nécessiter d'énergie supplémentaire. Ce phénomène s'arrête lorsque les deux liquides séparés par la membrane atteignent la même concentration, créant des milieux équilibré dit isotoniques. Cette notion, fondamentale en chimie, physiologie et biologie cellulaire, a permis de mieux comprendre les échanges chimiques au sein des organismes vivants. | L'osmose est un phénomène naturel où des molécules de solvant, habituellement de l'eau, se déplacent à travers une membrane semi-perméable d'une zone de concentration plus faible vers une zone de concentration plus élevée, sans nécessiter d'énergie supplémentaire. Ce phénomène s'arrête lorsque les deux liquides séparés par la membrane atteignent la même concentration, créant des milieux équilibré dit isotoniques. Cette notion, fondamentale en chimie, physiologie et biologie cellulaire, a permis de mieux comprendre les échanges chimiques au sein des organismes vivants. | ||
| Ligne 112 : | Ligne 123 : | ||
L'osmose est un mécanisme physico-chimique où des molécules de solvant, principalement de l'eau, traversent une membrane semi-perméable en raison d'une différence de concentration de solutés, créant ainsi une pression osmotique. Cette pression osmotique, résultant du potentiel osmotique, induit un déplacement du solvant de la région de moindre concentration (milieu hypotonique) vers celle de plus grande concentration (milieu hypertonique), atteignant un état d'équilibre osmotique (milieu isotonique). La tonicité, qui mesure la variation de concentration, influence la direction du flux osmotique. L'osmose joue un rôle fondamental en biologie cellulaire, contribuant à l'absorption des nutriments et à la régulation osmotique. Les mécanismes d'osmorégulation permettent aux organismes de maintenir un équilibre osmotique interne optimal face à des variations environnementales. Ainsi, l'osmose, illustrant des concepts avancés de transport passif, devient un concept central dans la compréhension des processus biologiques et chimiques complexes. | L'osmose est un mécanisme physico-chimique où des molécules de solvant, principalement de l'eau, traversent une membrane semi-perméable en raison d'une différence de concentration de solutés, créant ainsi une pression osmotique. Cette pression osmotique, résultant du potentiel osmotique, induit un déplacement du solvant de la région de moindre concentration (milieu hypotonique) vers celle de plus grande concentration (milieu hypertonique), atteignant un état d'équilibre osmotique (milieu isotonique). La tonicité, qui mesure la variation de concentration, influence la direction du flux osmotique. L'osmose joue un rôle fondamental en biologie cellulaire, contribuant à l'absorption des nutriments et à la régulation osmotique. Les mécanismes d'osmorégulation permettent aux organismes de maintenir un équilibre osmotique interne optimal face à des variations environnementales. Ainsi, l'osmose, illustrant des concepts avancés de transport passif, devient un concept central dans la compréhension des processus biologiques et chimiques complexes. | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
}}<!-- ******** Fin Fiche Didactique Définition ******************* --> | }}<!-- ******** Fin Fiche Didactique Définition ******************* --> | ||
| Ligne 444 : | Ligne 401 : | ||
<!-- ************ Commercez les modifications *********************--> | <!-- ************ Commercez les modifications *********************--> | ||
*'''[[Quelle est la différence entre osmose et diffusion ?]]''': L'osmose implique le mouvement net d'eau à travers une membrane semi-perméable en réponse à un gradient de concentration en soluté, tandis que la diffusion concerne le mouvement net de molécules de toute substance d'une région de concentration plus élevée vers une région de concentration plus faible. | *'''[[Quelle est la différence entre osmose et diffusion ?]]''': L'osmose implique le mouvement net d'eau à travers une membrane semi-perméable en réponse à un gradient de concentration en soluté, tandis que la diffusion concerne le mouvement net de molécules de toute substance d'une région de concentration plus élevée vers une région de concentration plus faible. | ||
| + | *'''[[Quels sont les différents types de relations osmotiques en biologie ?]]''': En biologie, il existe trois types de relations osmotiques : [[hypotonique]], [[isotonique]] et [[hypertonique]]. | ||
*'''[[Qu'est-ce qui distingue l'osmose de la capillarité ?]]''': L'osmose est le mouvement net d'eau à travers une membrane semi-perméable en réponse à un gradient de concentration en soluté, tandis que la capillarité est le phénomène de montée ou de descente des liquides à travers des structures capillaires en raison de forces intermoléculaires. | *'''[[Qu'est-ce qui distingue l'osmose de la capillarité ?]]''': L'osmose est le mouvement net d'eau à travers une membrane semi-perméable en réponse à un gradient de concentration en soluté, tandis que la capillarité est le phénomène de montée ou de descente des liquides à travers des structures capillaires en raison de forces intermoléculaires. | ||
*'''[[L'osmose est-elle un processus actif ou passif ?]]''': L'osmose est un processus passif car il ne nécessite pas d'énergie supplémentaire pour se produire. | *'''[[L'osmose est-elle un processus actif ou passif ?]]''': L'osmose est un processus passif car il ne nécessite pas d'énergie supplémentaire pour se produire. | ||
| Ligne 539 : | Ligne 497 : | ||
|Références=<!-- Complétez ou Supprimez les lignes non utilisées--> | |Références=<!-- Complétez ou Supprimez les lignes non utilisées--> | ||
<!-- ****************** Commercez les modifications ************--> | <!-- ****************** Commercez les modifications ************--> | ||
| − | {{@}} | + | {{@}} [[{{PAGENAME}} - Formation/Apprentissage]]: Exemples de plans structurés [[Fiche Apprentissage/Formation - Prompt | ('''+''')]] |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
{{@}} Ressources éducatives et académiques | {{@}} Ressources éducatives et académiques | ||
| Ligne 555 : | Ligne 508 : | ||
{{Gg.edu}} [https://scholar.google.com/scholar?q={{PAGENAMEE}} {{PAGENAMEE}}] | {{Gg.edu}} [https://scholar.google.com/scholar?q={{PAGENAMEE}} {{PAGENAMEE}}] | ||
{{core}} [https://core.ac.uk/search?q={{PAGENAMEE}} {{PAGENAMEE}}] | {{core}} [https://core.ac.uk/search?q={{PAGENAMEE}} {{PAGENAMEE}}] | ||
| + | {{libretexts}} [https://query.libretexts.org/Special:Search?qid=&fpid=230&fpth=&query={{PAGENAMEE}}&type=wiki&path=Francais {{PAGENAMEE}}] | ||
| + | {{sukudir}} [https://sukudir.com/search?q={{PAGENAMEE}}&language=fr-FR&time_range=&safesearch=0&categories=science {{PAGENAMEE}}] | ||
{{@}} Autres ressources | {{@}} Autres ressources | ||
| − | tpe-osmose.e-monsite.com | + | * tpe-osmose.e-monsite.com |
| − | leskapablesenscience.weebly.com | + | * leskapablesenscience.weebly.com |
| − | WWW.liens-internes.com | + | * WWW.liens-internes.com |
* [[https://query.libretexts.org/Francais/Livre_%3A_Biologie_g%C3%A9n%C3%A9rale_(OpenStax)/7%3A_Structure_et_fonction_des_animaux/41%3A_R%C3%A9gulation_osmotique_et_excr%C3%A9tion/41.1%3A_Osmor%C3%A9gulation_et_%C3%A9quilibre_osmotique - Osmorégulation et équilibre osmique]] | * [[https://query.libretexts.org/Francais/Livre_%3A_Biologie_g%C3%A9n%C3%A9rale_(OpenStax)/7%3A_Structure_et_fonction_des_animaux/41%3A_R%C3%A9gulation_osmotique_et_excr%C3%A9tion/41.1%3A_Osmor%C3%A9gulation_et_%C3%A9quilibre_osmotique - Osmorégulation et équilibre osmique]] | ||
* [[..................]] | * [[..................]] | ||
Version actuelle datée du 11 avril 2024 à 13:54
 Traduction
Traduction
 Définition
Définition
Domaine, Discipline, Thématique
Biologie / Chimie / Physique / Physiologie / Biochimie / Biophysique / Médecine / Pharmacie / Science des matériaux / Ingénierie / Botanique / Zoologie / Microbiologie / Biologie cellulaire / Biologie moléculaire / Néphrologie / Thermodynamique / Science de l'environnement / Biologie membranaire / Biomécanique / Pharmacologie / Toxicologie / Nutrition / Agronomie / Science alimentaire / Biotechnologie / Génie biomédical / Chimie analytique / Chimie physique / Bioinformatique / Génomique / Protéomique / Métabolomique / Écologie / Évolution / Anthropologie / Géologie / Hydrologie / Limnologie / Océanographie / Astrobiologie / Science des colloïdes / Physico-chimie / Nanotechnologie / Microfluidique / Biomimétisme / Robotique / Intelligence artificielle / Éthique / Epistémologie /
Définition écrite
L'osmose est un phénomène physico-chimique fondamental où des molécules de solvant, principalement de l'eau, traversent une membrane semi-perméable en réponse à une différence de concentration de solutés, conduisant à la création d'une pression osmotique. Ce processus, essentiel en chimie, physiologie et biologie cellulaire, implique un mouvement passif du solvant de la zone de moindre concentration (milieu hypotonique) vers la zone de plus grande concentration (milieu hypertonique), atteignant un état d'équilibre osmotique dans des milieux isotoniques. L'osmose régule des mécanismes biologiques tels que l'absorption cellulaire et le maintien de l'équilibre osmotique, permettant aux organismes de s'adapter aux variations environnementales. En tant que concept central, l'osmose éclaire la compréhension des processus complexes de transport passif et de régulation osmotique dans les systèmes biologiques.
L'osmose est un phénomène naturel où des molécules de solvant, habituellement de l'eau, se déplacent à travers une membrane semi-perméable d'une zone de concentration plus faible vers une zone de concentration plus élevée, sans nécessiter d'énergie supplémentaire. Ce phénomène s'arrête lorsque les deux liquides séparés par la membrane atteignent la même concentration, créant des milieux équilibré dit isotoniques. Cette notion, fondamentale en chimie, physiologie et biologie cellulaire, a permis de mieux comprendre les échanges chimiques au sein des organismes vivants.
L'osmose est un processus passif complexe impliquant le passage sélectif de molécules de solvant, habituellement de l'eau, à travers une membrane semi-perméable. Ce mouvement se dirige du milieu hypotonique vers l'hypertonique jusqu'à atteindre un équilibre, créant ainsi des milieux isotoniques. La pression osmotique, régulée par la différence de concentration de solutés, est compensée par la pression hydrostatique. Cette compréhension a des implications significatives en chimie, en physiologie et en biologie cellulaire, éclairant les mécanismes d'osmose et d'équilibre osmotique au sein des systèmes biologiques.
L'osmose, mécanisme de transport passif, décrit le déplacement sélectif de molécules de solvant, principalement de l'eau, à travers une membrane semi-perméable. Initiée par la différence de concentration, elle conduit à la formation de milieux isotoniques lorsque l'équilibre est atteint. La pression osmotique, résultante de cette différence, est la force motrice qui guide le solvant d'une région de moindre tonicité vers une région de tonicité plus élevée. Ce processus est fondamental pour des mécanismes biologiques tels que l'absorption cellulaire et le maintient de l'équilibre osmotique dans les systèmes biologiques.
L'osmose est un mécanisme physico-chimique où des molécules de solvant, principalement de l'eau, traversent une membrane semi-perméable en raison d'une différence de concentration de solutés, créant ainsi une pression osmotique. Cette pression osmotique, résultant du potentiel osmotique, induit un déplacement du solvant de la région de moindre concentration (milieu hypotonique) vers celle de plus grande concentration (milieu hypertonique), atteignant un état d'équilibre osmotique (milieu isotonique). La tonicité, qui mesure la variation de concentration, influence la direction du flux osmotique. L'osmose joue un rôle fondamental en biologie cellulaire, contribuant à l'absorption des nutriments et à la régulation osmotique. Les mécanismes d'osmorégulation permettent aux organismes de maintenir un équilibre osmotique interne optimal face à des variations environnementales. Ainsi, l'osmose, illustrant des concepts avancés de transport passif, devient un concept central dans la compréhension des processus biologiques et chimiques complexes. |
Définition graphique
- AUTRES MEDIAS
![]() Osmose
Osmose
![]() Osmose: Images sur Bing
Osmose: Images sur Bing
![]() Osmose: (Discipline)
Osmose: (Discipline)
![]() Osmose
Osmose
![]() Osmose
Osmose
![]() Représentation graphique spatiale Osmose: Carte conceptuelle (cmap)
Représentation graphique spatiale Osmose: Carte conceptuelle (cmap)
![]() Document PDF Osmose: Document PDF
Document PDF Osmose: Document PDF
 Concepts ou notions associés
Concepts ou notions associés
Membrane semi-perméable / Hypotonique / Isotonique / Hypertonique / Plasmolyse / Turgescence / Transport membranaire passif / Pression osmotique / Equilibre osmotique / Gradient de concentration / Solvant / Soluté / Solution / Osmorégulation / Osmose inverse / Diffusion / Capillarité / Exosmose / Endosmose / Concentration / Animal osmoconformeur / Plante halophyte Poïkilotherme / Pression hydrostatique / Perméabilité / Transport membranaire / Transport membranaire actif / Potentiel hydrique / Osmolalité / Résistance osmotique / Equilibre électrolytique / Équilibre hydrique / Équilibre osmotique / Pression oncotique / Assimilation osmotique / Osmose cellulaire / Coefficient de réflexion / Phénomène d'osmolarité / Colloïde / Osmoconcentration / Membrane sélectivement perméable / Filtration glomérulaire / Échangeur ionique / Semi-perméabilité / Homéostasie / Phénomène colligatif / État colloïdal / Dialyse / Réabsorption / Sécrétion / Aquaporine / Réflexion osmotique / Hyperosmolaire / Hypo-osmolaire / Osmométrie / Éléments osmotiques / Osmophiles / Régulation osmotique / Pression osmotique effective / Coligand / Cotransport / Contre-transport / Perméabilité sélective / Équation de Gibbs-Donnan / Fraction molaire / Loi de Raoult / Solution colligative / Cryoscopie / Osmorégulateur / Osmolalité / Osmorégulation marine / Osmotrophie / Plasmoptysie / Diurèse osmotique / Antidiurèse / Osmose intracellulaire / Osmose extracellulaire / Échange osmotique / Thérapie osmotique / Osmotique / Pression osmotique plasmatique / Viscosité / Équation de Van't Hoff / Loi de Fick / Loi de Starling /
 Exemples, applications, utilisations
Exemples, applications, utilisations
|
Plusieurs exemples illustrent la diversité des applications de l'osmose dans différents domaines, allant de la biologie cellulaire à l'industrie alimentaire en passant par la technologie de purification de l'eau et l'industrie pharmaceutique.
|
 Erreurs ou confusions éventuelles
Erreurs ou confusions éventuelles
![]() Exemples de difficultés de compréhension ou d'interprétation courantes:
Exemples de difficultés de compréhension ou d'interprétation courantes:
- Osmose comme un processus de filtration : Une conception erronée courante est de considérer l'osmose comme un processus de filtration où les solutés sont filtrés à travers une membrane. Cette conception erronée peut découler d'une confusion entre l'osmose et d'autres processus de filtration tels que la filtration glomérulaire dans les reins. En réalité, l'osmose est le mouvement net d'eau à travers une membrane semi-perméable due à une différence de concentration de solutés de part et d'autre de la membrane.
- Osmose comme un processus actif : Certaines personnes peuvent confondre l'osmose avec un processus actif où l'énergie est dépensée pour déplacer les molécules à travers une membrane. Cette confusion peut provenir de l'association de l'osmose avec d'autres processus de transport actif, tels que le transport actif primaire ou le transport actif secondaire. En réalité, l'osmose est un processus passif qui ne nécessite pas d'énergie supplémentaire pour le mouvement de l'eau à travers la membrane.
- Osmose comme un processus unidirectionnel : Une conception erronée commune est de considérer l'osmose comme un processus unidirectionnel où l'eau se déplace toujours de la solution hypotonique vers la solution hypertonique. Cette conception peut provenir d'une simplification excessive du concept d'osmose. En réalité, l'osmose peut se produire dans les deux sens, en fonction des différences de concentration de solutés de part et d'autre de la membrane semi-perméable.
- Importance de l'osmose dans la biologie et d'autres domaines : Certains élèves pourraient ne pas saisir pleinement l'importance de l'osmose dans des contextes biologiques plus larges, tels que le fonctionnement des cellules, des tissus et des organismes. Souligner les implications biologiques et physiologiques de l'osmose peut aider à renforcer sa pertinence.
- Osmose uniquement dans les systèmes biologiques : Une autre conception erronée est de limiter l'osmose aux systèmes biologiques, tels que les cellules ou les organismes vivants. Cette conception peut découler d'une vision anthropocentrique qui accorde une importance excessive aux processus biologiques par rapport aux phénomènes physiques et chimiques plus généraux. En réalité, l'osmose est un phénomène physique fondamental qui se produit dans une variété de contextes, y compris en chimie et en ingénierie.
- Confusion entre osmose et diffusion: Les élèves peuvent avoir du mal à différencier osmose et diffusion, car les deux impliquent le mouvement de molécules à travers une membrane. Il est important de clarifier que l'osmose est un type spécifique de diffusion où l'eau se déplace à travers une membrane semi-perméable.
- Compréhension de la membrane semi-perméable : Les élèves peuvent avoir du mal à comprendre le concept d'une membrane semi-perméable. Expliquer que cette membrane permet le passage de certaines substances (comme l'eau) tout en empêchant le passage d'autres substances (comme les solutés) est crucial.
- Définition précise de l'osmose : Certains élèves pourraient avoir une définition vague de l'osmose, la considérant simplement comme le mouvement de l'eau à travers une membrane. Il est important de souligner que l'osmose implique le mouvement de l'eau d'une région de concentration hydrique plus élevée vers une région de concentration hydrique plus faible à travers une membrane semi-perméable.
![]() Notions de concentration et de pression osmotique :
Notions de concentration et de pression osmotique :
- Comprendre les concepts de concentration et de pression osmotique peut être difficile pour certains élèves, en particulier ceux qui n'ont pas encore une solide compréhension de la chimie. Une analogie avec une balance entre les concentrations de soluté de chaque côté de la membrane peut aider à clarifier ces concepts.
- Contextualisation dans des exemples concrets : Les élèves pourraient avoir du mal à appliquer le concept d'osmose à des exemples concrets, tels que la régulation du volume cellulaire ou l'absorption d'eau par les plantes. Utiliser des démonstrations en classe ou des simulations informatiques peut aider à illustrer ces applications.
- Relation avec la pression hydrostatique : Comprendre comment la pression hydrostatique influe sur l'osmose peut être complexe. Expliquer comment la pression hydrostatique peut contrecarrer le mouvement de l'eau par osmose peut aider à clarifier ce concept.
- Phénomène d'osmorégulation : Les élèves pourraient avoir du mal à comprendre comment les organismes régulent leur équilibre osmotique interne pour maintenir l'homéostasie. Expliquer les mécanismes d'osmorégulation chez différents organismes peut être nécessaire pour une compréhension approfondie.
![]() Confusions ou glissement de sens potentiels
Confusions ou glissement de sens potentiels
- Osmose - Diffusion - Capillarité: L'osmose se réfère spécifiquement au mouvement d'eau à travers une membrane semi-perméable en réponse à un gradient de concentration en soluté, la diffusion est le mouvement net de molécules de toute substance d'une région de concentration plus élevée vers une région de concentration plus faible, et la capillarité est le phénomène de montée ou de descente des liquides à travers des structures capillaires en raison de forces intermoléculaires.
- Osmose - Diffusion - Transport actif : Les élèves peuvent confondre l'osmose, la diffusion et le transport actif en tant que processus de mouvement de substances à travers une membrane. L'osmose se réfère spécifiquement au mouvement net d'eau à travers une membrane semi-perméable en réponse à un gradient de concentration en soluté. La diffusion concerne le mouvement net de molécules de toute substance d'une région de concentration plus élevée vers une région de concentration plus faible. Le transport actif, quant à lui, implique le mouvement de substances contre leur gradient de concentration, nécessitant de l'énergie sous forme d'ATP. Il est crucial de clarifier ces différences pour une compréhension précise des processus de transport à travers les membranes cellulaires.
- Osmose - Turgescence : Une autre confusion peut survenir entre l'osmose et la turgescence, en particulier dans le contexte des cellules végétales. L'osmose est le processus par lequel l'eau passe à travers la membrane cellulaire pour équilibrer les concentrations de soluté, tandis que la turgescence se réfère à l'état d'une cellule végétale lorsque sa vacuole est pleine d'eau, exerçant une pression contre la paroi cellulaire. Bien que l'osmose soit nécessaire à la turgescence, elles représentent des concepts différents.
- Osmose - Endocytose/Exocytose : Les élèves peuvent également confondre l'osmose avec les processus d'endocytose et d'exocytose. L'osmose concerne le mouvement passif d'eau à travers une membrane en réponse à un gradient de concentration en soluté, tandis que l'endocytose et l'exocytose sont des processus actifs par lesquels les cellules englobent des substances à l'intérieur ou les libèrent à l'extérieur de la cellule en formant des vésicules membranaires. Il est important de clarifier que l'osmose ne nécessite pas d'énergie directe de la cellule, tandis que l'endocytose et l'exocytose le font.
- Pression osmotique - Pression hydrostatique : Les élèves pourraient confondre la pression osmotique avec la pression hydrostatique. La pression osmotique est la pression exercée par un liquide (généralement de l'eau) à travers une membrane semi-perméable en réponse à une différence de concentration en soluté de part et d'autre de la membrane. En revanche, la pression hydrostatique est la pression exercée par un fluide en raison de sa gravité ou de sa profondeur. Il est essentiel de distinguer ces deux concepts pour comprendre comment la pression osmotique influence le mouvement d'eau à travers une membrane.
- Perméabilité - Osmose : Une confusion potentielle peut survenir entre la perméabilité et l'osmose. La perméabilité se réfère à la capacité d'une membrane à permettre le passage de certaines substances, tandis que l'osmose est le mouvement net d'eau à travers une membrane semi-perméable en réponse à un gradient de concentration en soluté. Il est important de comprendre que l'osmose dépend de la perméabilité de la membrane, mais ce ne sont pas des concepts interchangeables.
- Turgescence - Plasmolyse : Les élèves pourraient également confondre la turgescence avec la plasmolyse. La turgescence se produit lorsque la vacuole d'une cellule végétale est pleine d'eau, exerçant une pression contre la paroi cellulaire, tandis que la plasmolyse se produit lorsque la cellule perd de l'eau et que la membrane plasmique se retire de la paroi cellulaire. Bien que liés aux fluctuations de la pression osmotique, ce sont des phénomènes différents qui se produisent dans des conditions différentes.
- Diffusion - Dialyse : Une autre confusion potentielle est entre la diffusion et la dialyse. La diffusion est le mouvement net de molécules de toute substance d'une région de concentration plus élevée vers une région de concentration plus faible, tandis que la dialyse est le processus de séparation de substances à travers une membrane semi-perméable en fonction de leur taille et de leur charge. Bien que la diffusion puisse jouer un rôle dans la dialyse, ce sont des processus distincts.
- Osmose - Actif/Passif : Une erreur fréquente est de considérer l'osmose comme un phénomène actif (nécessitant de l'énergie) ou passif. L'osmose est en fait un processus passif, car il ne nécessite pas d'énergie directe de la part de la cellule. C'est la différence de concentration en soluté de part et d'autre de la membrane qui entraîne le mouvement net d'eau à travers la membrane. Le transport actif, en revanche, est un processus qui nécessite de l'énergie sous forme d'ATP pour transporter des substances contre leur gradient de concentration.
- Osmose - Cellule animale uniquement : Une autre erreur courante est de croire que l'osmose se produit uniquement au sein des cellules animales. En réalité, l'osmose est un processus fondamental qui se produit dans tous les types de cellules, qu'elles soient animales, végétales, bactériennes ou fongiques. Le mouvement d'eau à travers une membrane semi-perméable en réponse à un gradient de concentration en soluté est une caractéristique universelle de la biologie cellulaire.
- Osmose - Filtration : Une confusion potentielle existe entre l'osmose et la filtration. Alors que l'osmose implique le mouvement d'eau à travers une membrane semi-perméable en réponse à un gradient de concentration en soluté, la filtration est le processus de passage de liquide et de solutés à travers une membrane sous l'influence d'une force extérieure, telle que la pression hydrostatique. Il est important de clarifier que la filtration ne dépend pas nécessairement de la différence de concentration en soluté de part et d'autre de la membrane, contrairement à l'osmose.
- Osmose - Équilibre osmotique : Les élèves peuvent confondre l'osmose avec l'équilibre osmotique. L'osmose se réfère au mouvement net d'eau à travers une membrane semi-perméable en réponse à un gradient de concentration en soluté, tandis que l'équilibre osmotique désigne l'état où il n'y a pas de mouvement net d'eau à travers la membrane car les concentrations en soluté de part et d'autre sont égales. Comprendre cette distinction est crucial pour saisir comment l'osmose contribue à maintenir l'équilibre osmotique dans les systèmes biologiques.
- Osmose - Guttation : Une autre confusion potentielle pourrait survenir entre l'osmose et la guttation, en particulier chez les plantes. L'osmose se réfère au mouvement net d'eau à travers une membrane semi-perméable en réponse à un gradient de concentration en soluté, tandis que la guttation est le processus par lequel les plantes expulsent de petites gouttes d'eau par leurs feuilles à la suite d'une accumulation d'eau dans les tissus. Bien que liés à l'absorption d'eau par les racines, ce sont des processus distincts qui se produisent à différents niveaux d'organisation chez les plantes.
- Osmose - Évaporation : Une confusion potentielle pourrait se produire entre l'osmose et l'évaporation. Alors que l'osmose implique le mouvement net d'eau à travers une membrane semi-perméable en réponse à un gradient de concentration en soluté, l'évaporation est le processus par lequel l'eau passe de l'état liquide à l'état gazeux et quitte ainsi le système. Bien que l'osmose puisse influencer la distribution de l'eau dans un système, l'évaporation représente une perte d'eau indépendante des processus osmotiques.
- Osmose - Différence de pression : Les élèves pourraient confondre l'osmose avec les processus impliquant une différence de pression, tels que la filtration ou la pompe ionique. Alors que l'osmose est spécifiquement liée au mouvement d'eau à travers une membrane semi-perméable en réponse à un gradient de concentration en soluté, d'autres processus comme la filtration impliquent le passage de liquide et de solutés à travers une membrane sous l'influence d'une pression extérieure. Comprendre cette distinction est essentiel pour une compréhension précise des mécanismes de transport à travers les membranes biologiques.
- Osmose - Déshydratation : Une autre confusion potentielle pourrait survenir entre l'osmose et la déshydratation. Alors que l'osmose se réfère au mouvement net d'eau à travers une membrane semi-perméable en réponse à un gradient de concentration en soluté, la déshydratation est le processus de perte nette d'eau dans un organisme ou une cellule. Bien que l'osmose puisse contribuer à la déshydratation dans certains contextes, ils représentent des phénomènes différents avec des implications distinctes pour les systèmes biologiques.
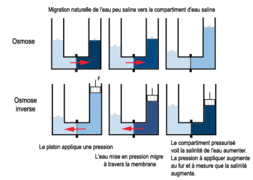
- Osmose - Osmose inverse : Une confusion potentielle peut exister entre l'osmose et l'osmose inverse. Alors que l'osmose est le processus naturel par lequel l'eau se déplace à travers une membrane semi-perméable pour équilibrer les concentrations de soluté de part et d'autre de la membrane, l'osmose inverse est une technique de purification de l'eau dans laquelle une pression externe est appliquée pour forcer l'eau à travers une membrane semi-perméable, éliminant ainsi les solutés indésirables. Il est important de comprendre que l'osmose inverse est une application technologique de l'osmose qui fonctionne à l'envers du processus naturel, et qu'elle nécessite une énergie externe pour être réalisée, contrairement à l'osmose qui est un processus passif.
- Osmose - Hypotonique - Isotonique - Hypertonique et Hypotonique - Isotonique - Hypertonique: (Associer les termes "isotonique", "hypertonique" et "hypotonique" à l'osmose) Les termes "isotonique", "hypertonique" et "hypotonique" sont en effet souvent associés à des solutions dans le contexte de la biologie cellulaire et de la physiologie, où ils décrivent la concentration relative de solutés à l'intérieur et à l'extérieur des cellules. Cependant, ils ne sont pas spécifiquement liés à l'osmose. Ils peuvent également être utilisés dans d'autres contextes pour décrire des solutions ayant différentes concentrations de solutés.
* Dans le contexte de l'osmose, ces termes peuvent être utilisés pour décrire les solutions par rapport à la cellule, mais ils ne sont pas directement synonymes des processus d'endosmose ou d'exosmose. L'endosmose et l'exosmose font référence au mouvement de l'eau à travers une membrane semi-perméable en réponse à une différence de concentration en solutés de part et d'autre de la membrane, tandis que l'isotonie, l'hypertonie et l'hypotonie se réfèrent à l'état de la solution par rapport à la cellule.
 Questions possibles
Questions possibles
- Quelle est la différence entre osmose et diffusion ?: L'osmose implique le mouvement net d'eau à travers une membrane semi-perméable en réponse à un gradient de concentration en soluté, tandis que la diffusion concerne le mouvement net de molécules de toute substance d'une région de concentration plus élevée vers une région de concentration plus faible.
- Quels sont les différents types de relations osmotiques en biologie ?: En biologie, il existe trois types de relations osmotiques : hypotonique, isotonique et hypertonique.
- Qu'est-ce qui distingue l'osmose de la capillarité ?: L'osmose est le mouvement net d'eau à travers une membrane semi-perméable en réponse à un gradient de concentration en soluté, tandis que la capillarité est le phénomène de montée ou de descente des liquides à travers des structures capillaires en raison de forces intermoléculaires.
- L'osmose est-elle un processus actif ou passif ?: L'osmose est un processus passif car il ne nécessite pas d'énergie supplémentaire pour se produire.
- Pourquoi l'osmose est-elle importante pour les cellules végétales ?: L'osmose est importante pour les cellules végétales car elle régule la turgescence cellulaire, contribuant ainsi à maintenir la rigidité de la plante.
- Quels facteurs influencent l'osmose ?: Les principaux facteurs influençant l'osmose sont le gradient de concentration en soluté, la perméabilité de la membrane et la température.
- Quelle est la différence entre l'osmose et l'osmose inverse ?: L'osmose est le mouvement naturel de l'eau à travers une membrane semi-perméable, tandis que l'osmose inverse est un processus où une pression est appliquée pour forcer l'eau à travers une membrane semi-perméable afin de la purifier.
- Quels sont les effets de l'osmose sur les organismes marins ?: L'osmorégulation est essentielle pour les organismes marins afin de maintenir leur équilibre osmotique avec leur environnement salin et d'éviter la déshydratation ou la surhydratation.
- Comment l'osmose est-elle utilisée dans l'industrie alimentaire ?: L'osmose est utilisée dans l'industrie alimentaire pour des processus tels que la saumure et la déshydratation des aliments, contribuant ainsi à leur conservation et à l'amélioration de leur saveur.
- Quelles sont les implications de l'osmose dans la recherche médicale ?: En recherche médicale, l'osmose est étudiée dans le contexte de la physiologie cellulaire et de la pathologie, notamment dans des conditions telles que l'oedème, où des déséquilibres osmotiques peuvent se produire dans les tissus.
- Comment les membranes semi-perméables sont-elles utilisées dans les applications d'osmose ?: Les membranes semi-perméables sont utilisées dans les applications d'osmose pour permettre le passage sélectif de l'eau tout en retenant les solutés, permettant ainsi la purification de l'eau ou le contrôle de la concentration des solutés.
- Quelles sont les différences entre pression osmotique et pression hydrostatique ?: La pression osmotique est la pression exercée par un gradient de concentration en soluté de part et d'autre d'une membrane semi-perméable, tandis que la pression hydrostatique est la pression exercée par une colonne de liquide due à la gravité ou à une force externe.
- Définir osmose inverse et quelles sont ses applications ?: L'osmose inverse est un processus de purification de l'eau où une pression est appliquée pour forcer l'eau à travers une membrane semi-perméable, éliminant ainsi les impuretés et les contaminants. Ses applications incluent la production d'eau potable à partir d'eau saumâtre ou de mer, le traitement des eaux usées et la production d'eau pour des applications industrielles telles que l'électronique et la pharmacie.
- Quelles sont les importances des phénomènes liés à l'osmose pour la vie de la cellule ?: Les phénomènes liés à l'osmose sont essentiels pour la vie cellulaire car ils régulent l'équilibre hydrique, la turgescence cellulaire, le transport des nutriments et des déchets, ainsi que la communication cellulaire. Ils permettent également le maintien de l'intégrité structurelle et fonctionnelle des cellules dans des environnements variables.
- Quelle est la différence entre pression osmotique et pression hydrostatique ?: La pression osmotique est la pression exercée par un gradient de concentration en soluté de part et d'autre d'une membrane semi-perméable, tandis que la pression hydrostatique est la pression exercée par une colonne de liquide due à la gravité ou à une force externe. Cette différence est souvent source de confusion car les deux types de pression peuvent influencer le mouvement de l'eau, mais leurs mécanismes et leurs effets sont distincts dans les phénomènes physiques et biologiques.
- Pourquoi utilise-t-on généralement une concentration de 9 g/L en glucose ou en NaCl lors des perfusions ?: Cette concentration est couramment utilisée car elle est proche de la concentration physiologique du glucose et du chlorure de sodium dans le plasma sanguin. En maintenant une concentration similaire à celle du plasma, les solutions de perfusion minimisent les perturbations de l'équilibre osmotique et électrolytique dans l'organisme, ce qui contribue à une meilleure compatibilité et tolérance lors de l'administration intraveineuse.
 Liaisons enseignements et programmes
Liaisons enseignements et programmes
Idées ou Réflexions liées à son enseignement
- Utilisation d'analogies et de métaphores :
Exemple : Comparer l'osmose à un jeu de balançoire où l'eau représente les enfants et la membrane semi-perméable la barre centrale de la balançoire. Lorsque les enfants (molécules d'eau) sont déséquilibrés de part et d'autre de la barre (la membrane), ils se déplacent pour rétablir l'équilibre.
- Développement d'activités pratiques et expérimentales :
Exemple : Organiser une expérience en classe où les élèves placent des œufs dans des solutions de différentes concentrations de sel pour observer l'effet de l'osmose sur la taille et la texture des œufs au fil du temps.
- Utilisation de supports visuels et multimédias :
Exemple : Diffuser une vidéo explicative animée montrant le processus d'osmose au niveau moléculaire, avec des animations illustrant comment les molécules d'eau traversent une membrane semi-perméable en réponse à un gradient de concentration en soluté.
- Encouragement du questionnement et de la discussion :
Exemple : Diviser la classe en petits groupes et leur poser des questions provocantes sur l'osmose, comme "Pourquoi l'eau se déplace-t-elle à travers une membrane semi-perméable ?" ou "Quel est l'effet de la pression osmotique sur le mouvement de l'eau ?" pour stimuler la réflexion et la discussion.
- Étude de cas et applications concrètes :
Exemple : Présenter aux élèves une étude de cas sur la régulation osmotique chez les poissons d'eau douce et d'eau salée, en expliquant comment ils adaptent leur comportement et leur physiologie pour maintenir l'équilibre osmotique dans des environnements différents.
D'autres exemples: Exemples d'osmorégulation chez les mammifères ou Exemples d'osmorégulation chez les végétaux
- Évaluation formative régulière :
Exemple : Distribuer des questionnaires à choix multiples ou des questions ouvertes après chaque leçon sur l'osmose, puis discuter des réponses en classe pour identifier et corriger les erreurs conceptuelles.
- Différenciation pédagogique :
Exemple : Offrir des activités supplémentaires ou des ressources en ligne pour les élèves ayant des difficultés à comprendre l'osmose, comme des tutoriels vidéo ou des exercices interactifs sur des plateformes d'apprentissage en ligne.
- Expériences pratiques sur des cellules végétales :
a. Observation de la plasmolyse : Placez des tranches minces d'oignon rouge dans différentes solutions de concentrations de sel variées pendant quelques minutes. Les élèves pourront observer comment les cellules végétales se déshydratent et se rétractent à mesure que l'eau sort de la vacuole en réponse à la concentration saline élevée.
b. Guttation chez les plantes : Placez une plante en pot dans des conditions de haute humidité et observez les petites gouttelettes d'eau qui se forment sur les bords des feuilles tôt le matin. Les élèves pourront observer comment la pression de turgescence fait sortir l'eau par les stomates des feuilles.
- Expériences pratiques sur des cellules animales :
a. Osmose à travers la membrane cellulaire : Utilisez des œufs de poule comme modèle de cellules animales. Plongez-les dans différentes solutions de concentration de sucre ou de sel et observez comment la taille et le poids des œufs changent au fil du temps en raison de l'osmose.
b. Hémolyse et crenation des globules rouges : Placez des globules rouges dans des solutions hypotoniques, isotones et hypertoniques et observez les changements de forme des globules rouges en raison du mouvement d'eau à travers leur membrane.
- Réalisation d'expériences sur des hématies mettant en évidence le phénomène d'osmose.
![]() Comparaisons réflexives avec des exemples concrets :
Comparaisons réflexives avec des exemples concrets :
- Exemples précis pour illustrer des phénomènes d'osmose, où le mouvement d'eau à travers une membrane semi-perméable se produit en réponse à un gradient de concentration en soluté, conduisant à des changements observables dans la structure ou la texture des matériaux impliqués.
Déshydratation des raisins pour faire des raisins secs : Lorsque des raisins sont laissés à sécher, l'eau à l'intérieur des cellules des raisins s'évapore progressivement, créant un environnement hypertonic à l'intérieur des cellules par rapport à l'extérieur. Cela entraîne un mouvement d'eau hors des cellules vers l'environnement extérieur, ce qui provoque le rétrécissement des raisins et la formation de raisins secs.
Plongée d'une tranche de pomme dans une solution de sucre : Si vous plongez une tranche de pomme dans une solution concentrée de sucre, l'eau à l'intérieur des cellules de la pomme se déplacera hors des cellules vers la solution sucrée, car la solution est hypertonique par rapport à l'intérieur de la cellule. Cela entraînera le flétrissement de la tranche de pomme.
- Exemples précis pour illustrer des phénomènes qui ne sont pas des cas direct d'osmose: Exemple la salaison des olives et l'absorption du café sur une serviette bien qu'ils puissent être influencées par des principes similaires à ceux de l'osmose, ce sont principalement des processus de diffusion (pour la salaison des olives) et de capillarité (pour l'absorption du café) plutôt que des exemples directs d'osmose.
Salaison des olives : Lorsque les olives sont saumurées, elles sont immergées dans une solution saline pour les conserver. La saumure, qui est une solution concentrée de sel, crée un environnement hypertonique autour des cellules de la peau des olives. Cela entraîne une diffusion de l'eau hors des cellules d'olive vers la solution de saumure, réduisant ainsi le volume des cellules et les rendant plus fermes. Ce processus est similaire à l'osmose dans le sens où il implique un mouvement d'eau à travers une membrane semi-perméable (la membrane cellulaire des olives), mais la salaison est davantage un processus de diffusion que d'osmose, car elle ne dépend pas nécessairement d'un gradient de concentration en soluté.
Absorption du café sur une serviette : Lorsque vous renversez du café sur une serviette en papier, le café est absorbé par la serviette. Ce processus est principalement dû à la capillarité des fibres de la serviette, qui attirent et absorbent le liquide par action capillaire. Bien que l'osmose puisse jouer un rôle mineur si le café contient des solutés (comme le sucre), le principal mécanisme d'absorption est la capillarité, qui est un processus différent de l'osmose.
La salaison des olives et l'absorption du café sur une serviette ne sont pas exactement des phénomènes d'osmose, bien qu'ils puissent être influencés par des principes similaires.
Education: Autres liens, sites ou portails
![]() Osmose - Formation/Apprentissage: Exemples de plans structurés (+)
Osmose - Formation/Apprentissage: Exemples de plans structurés (+)
![]() Ressources éducatives et académiques
Ressources éducatives et académiques
Osmose
Osmose
Osmose
Osmose
Osmose
Osmose
Osmose
Osmose
Osmose
Osmose
- tpe-osmose.e-monsite.com
- leskapablesenscience.weebly.com
- WWW.liens-internes.com
- [- Osmorégulation et équilibre osmique]
- ..................
- ..................
 Bibliographie
Bibliographie
Pour citer cette page: ([1])
ABROUGUI, M & al, 2024. Osmose. In Didaquest [en ligne]. <http:www.didaquest.org/wiki/Osmose>, consulté le 22, novembre, 2024
- Fowler, S., Roush, R., & Wise, J. (2013). Concepts of Biology. OpenStax. https://openstax.org/books/concepts-biology/pages/1-introduction.
- ..................
- ..................
- ..................
- Pages utilisant des arguments dupliqués dans les appels de modèle
- Sponsors Education
- Biologie (Concepts)
- Chimie (Concepts)
- Physique (Concepts)
- Physiologie (Concepts)
- Biochimie (Concepts)
- Biophysique (Concepts)
- Médecine (Concepts)
- Pharmacie (Concepts)
- Science des matériaux (Concepts)
- Ingénierie (Concepts)
- Botanique (Concepts)
- Zoologie (Concepts)
- Microbiologie (Concepts)
- Biologie cellulaire (Concepts)
- Biologie moléculaire (Concepts)
- Néphrologie (Concepts)
- Thermodynamique (Concepts)
- Science de l'environnement (Concepts)
- Biologie membranaire (Concepts)
- Biomécanique (Concepts)
- Pharmacologie (Concepts)
- Toxicologie (Concepts)
- Nutrition (Concepts)
- Agronomie (Concepts)
- Science alimentaire (Concepts)
- Biotechnologie (Concepts)
- Génie biomédical (Concepts)
- Chimie analytique (Concepts)
- Chimie physique (Concepts)
- Bioinformatique (Concepts)
- Génomique (Concepts)
- Protéomique (Concepts)
- Métabolomique (Concepts)
- Écologie (Concepts)
- Évolution (Concepts)
- Anthropologie (Concepts)
- Géologie (Concepts)
- Hydrologie (Concepts)
- Limnologie (Concepts)
- Océanographie (Concepts)
- Astrobiologie (Concepts)
- Science des colloïdes (Concepts)
- Physico-chimie (Concepts)
- Nanotechnologie (Concepts)
- Microfluidique (Concepts)
- Biomimétisme (Concepts)
- Robotique (Concepts)
- Intelligence artificielle (Concepts)
- Éthique (Concepts)
- Epistémologie (Concepts)
- Membrane semi-perméable
- Hypotonique
- Isotonique
- Hypertonique
- Plasmolyse
- Turgescence
- Transport membranaire passif
- Pression osmotique
- Equilibre osmotique
- Gradient de concentration
- Solvant
- Soluté
- Solution
- Osmorégulation
- Osmose inverse
- Diffusion
- Capillarité
- Exosmose
- Endosmose
- Concentration
- Animal osmoconformeur
- Plante halophyte Poïkilotherme
- Pression hydrostatique
- Perméabilité
- Transport membranaire
- Transport membranaire actif
- Potentiel hydrique
- Osmolalité
- Résistance osmotique
- Equilibre électrolytique
- Équilibre hydrique
- Équilibre osmotique
- Pression oncotique
- Assimilation osmotique
- Osmose cellulaire
- Coefficient de réflexion
- Phénomène d'osmolarité
- Colloïde
- Osmoconcentration
- Membrane sélectivement perméable
- Filtration glomérulaire
- Échangeur ionique
- Semi-perméabilité
- Homéostasie
- Phénomène colligatif
- État colloïdal
- Dialyse
- Réabsorption
- Sécrétion
- Aquaporine
- Réflexion osmotique
- Hyperosmolaire
- Hypo-osmolaire
- Osmométrie
- Éléments osmotiques
- Osmophiles
- Régulation osmotique
- Pression osmotique effective
- Coligand
- Cotransport
- Contre-transport
- Perméabilité sélective
- Équation de Gibbs-Donnan
- Fraction molaire
- Loi de Raoult
- Solution colligative
- Cryoscopie
- Osmorégulateur
- Osmorégulation marine
- Osmotrophie
- Plasmoptysie
- Diurèse osmotique
- Antidiurèse
- Osmose intracellulaire
- Osmose extracellulaire
- Échange osmotique
- Thérapie osmotique
- Osmotique
- Pression osmotique plasmatique
- Viscosité
- Équation de Van't Hoff
- Loi de Fick
- Loi de Starling
- Concepts
- Osmose
- Osmose (Concepts)
- Fiche conceptuelle didactique